Questões Militares
Sobre equilíbrio químico em química
Foram encontradas 200 questões
Um técnico em química, após buscar 4 reagentes no almoxarifado, verificou que os rótulos dos mesmos estavam ilegíveis. Sabendo-se que em cada frasco contém apenas um cátion, o técnico fez as seguintes experiências:
Frasco 1 + H2S -> precipitado preto
Frasco 1 + KI -> precipitado preto
Frasco 2 + NH4SCN -> coloração vermelha
Frasco 2 + NaOH → precipitado castanho
Frasco 3 + H2S → precipitado preto
Frasco 3 + dimetilglioxima → precipitado vermelho
Frasco 4 + uranil acetato de zinco → precipitado amarelo esverdeado
Frasco 4 + K2H2Sb2O7 → precipitado branco
De acordo com as experiências acima, é correto afirmar que
os cátions presentes nos frascos 1, 2, 3 e 4, são,
respectivamente:
Observe a reação química abaixo.

Sabendo que a reação química acima se processa a volume
constante, é correto afirmar que para aumentar a obtenção de
gás nitrogênio, deve-se
Analise as afirmativas abaixo.
I - quando Vb = ½ Ve , pH = pKa .
II - no ponto de equivalência, o pH será > 7,0
III- no ponto de equivalência, o pH será < 7,0
IV- a fenolftaleína (pH 8,0-9,6) pode ser usada como indicador.
V - o vermelho de metila (pH 4, 8-6, 0) pode ser usado como indicador.
Em relação a uma titulação de ácido acético 0,1M com
hidróxido de sódio 0,1M, é correto afirmar que:
Analise a tabela a seguir.
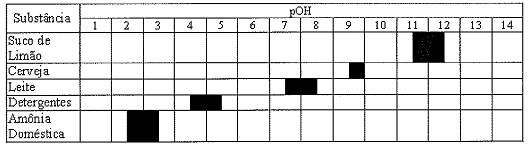
A tabela acima apresenta valores típicos de poH de soluções
comuns em água. Qual das soluções constantes dessa tabela
apreenta [H3O+] >
10-3 mol.L-1 ?
Observe a reação química a seguir.
CS2 (g) + 4H2 (g)  CH4 (g) + 2H2S
CH4 (g) + 2H2S
Em relação à reação química acima, assinale a opção que
apresenta a relação correta entre a lei da ação das massas,
as concentrações molares e a constante de equilíbrio da reação.
Analise a tabela a seguir.
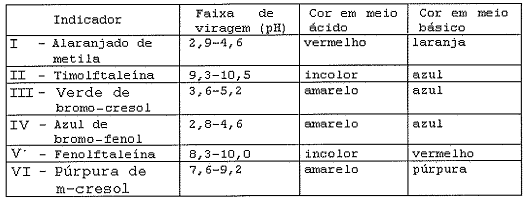
A tabela acima trata de algumas substâncias que podem ser utilizadas como indicadores de neutralização.
Que indicadores dessa tabela poderão ser utilizados para que
seja realizada a titulação de uma solução de amônia com
ácido clorídico?
Observe a tabela abaixo.
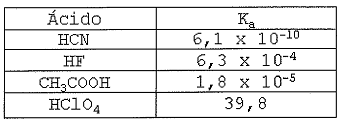
A tabela acima apresenta ácidos com suas respectivas constantes
de ionização (ka) . Assinale a opção que apresenta a
ordem decrescente de ionização desses ácidos.
Os corais fixam-se sobre uma base de carbonato de cálcio (CaCO3), produzido por eles mesmos. O carbonato de cálcio em contato com a água do mar e com o gás carbônico dissolvido pode estabelecer o seguinte equilíbrio químico para a formação do hidrogenocarbonato de cálcio:
CaCO3 (s) + CO2 (g) + H2O (l) 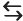 Ca(HCO3)2 (aq)
Ca(HCO3)2 (aq)
Considerando um sistema fechado onde ocorre o equilíbrio químico da reação mostrada acima,
assinale a alternativa correta.
Observe a reação a seguir.
H2C2O4(aq) + 2OH- (aq) → C2O4- (aq) + 2H2O(I)
Suponha que um técnico em química dissolva em água uma
amostra de 1,0g de ácido oxálico impuro e adicione algumas
gotas de indicador ácido-base. Em seguida, ele titula a
solução com NaOH 0,5M. A amostra consome 40mL da solução de
NaOH até atingir o ponto de equivalência. Qual é a massa de
ácido oxálico na amostra inicial?
Considere a seguinte reação reversível de dissociação de um ácido fraco.
HA <-> H+ + A-
Sabendo-se que o grau de ionização desta reação é 0,5 e que
antes do início da dissociação a concentração de ácido era de 1mol/l. Assinale a opção que apresenta o valor da constante
de equilíbrio.
Assinale a opção que completa corretamente as lacunas da sentença abaixo.
Considere que determinado ácido sofre uma diluição, de modo que sua concentração de íons H+ é alterada de 4x10-7mol/l para 5x10-8 mol/l. Sendo assim, é correto afirmar que o pH da solução original foi alterado de____________ para ___________ .
Dados:
log(2) = 0,301
log(3) = 0,477
log(5) = 0,698
Considere a reação reversível à seguir.
A + B <-> C + D
Sabendo-se que a notação [x] indica a concentração de um
determinado componente x, assinale a opção que apresenta o
valor da constante de equilíbrio da reação.
Com relação ao equilíbrio das reações químicas, analise as afirmativas abaixo.
I - A expressão matemática da constante de equilíbrio (K) relaciona as concentrações de reagentes e produtos no equilíbrio.
II - Os efeitos da perturbação de um equilíbrio químico são previstos pelo Princípio de Le Chatelier.
III- Quando o valor da constante de equilíbrio for grande (K muito maior que 1), a reação é favorável aos reagentes e as concentrações dos produtos no equilíbrio são menores que as dos reagentes.
Assinale a opção correta.