Questões Militares
Sobre equilíbrio químico em química
Foram encontradas 200 questões
Um experimento usado nas aulas práticas de laboratório da EsPCEx para compreensão da reatividade química é pautado na reação entre magnésio metálico (Mg0) e ácido clorídrico (HCl). Experimentalmente consiste em mergulhar uma fita de magnésio metálico numa solução de concentração 0,1 mol/L de ácido clorídrico. Acerca do processo acima descrito e considerando-se ocorrência de reação, são feitas as seguintes afirmativas:
I – A ocorrência da reação é evidenciada pela formação de bolhas do gás oxigênio.
II – Um dos produtos formados na reação é o óxido de magnésio.
III – O coeficiente estequiométrico do ácido clorídrico, após a escrita da equação da reação corretamente balanceada, é 2.
IV – O agente oxidante dessa reação de oxidorredução é o ácido clorídrico.
V – Considerando a solução inicial do ácido clorídrico de concentração 0,1 mol/L como 100 % ionizado (ácido forte), o pH dessa solução é 2.
Assinale a alternativa que apresenta todas as afirmativas corretas, dentre as listadas acima
O indicador vermelho de fenol apresenta cor amarela em
soluções aquosas de pH < 6,4, e, cor vermelha, em soluções
aquosas de pH > 8,2. Na água pura (pH = 7,0), esse indicador
apresenta cor laranja.
A uma amostra de água pura foi acrescentado o indicador vermelho de fenol. Em seguida, foi acrescentado certo óxido que mudou a cor apresentada por esse indicador de laranja para amarela. Esse óxido pode ter sido o
O cianeto de sódio (NaCN) é um sal usado principalmente na indústria de mineração para a recuperação de metais preciosos. É produzido industrialmente pela reação entre ácido cianídrico e hidróxido de sódio, sendo recuperado, após a sua purificação, na forma cristalina ou na forma de soluções contendo entre 27 e 32% m/m.
Sabendo-se que, à temperatura de 25°C, a constante de dissociação do NaCN em água é igual a Ka = 6,2x10-10, é correto afirmar que, para uma concentração igual a 6,25 mol.L-1 (~ 27% m/m), a solução é
As soluções-tampão são muito utilizadas em processos químicos e biológicos para efetuar o controle de pH.
Com relação a essas soluções, avalie as afirmativas a seguir.
I. Um exemplo de solução-tampão é aquela que contém uma base fraca e um sal derivado desta base fraca.
II. A solução-tampão resiste às variações de pH quando se adicionam pequenas quantidades de um ácido ou de uma base.
III. Adicionando-se quantidades equimolares de ácido acético e de hidróxido de sódio à água, obtém-se uma solução-tampão.
É correto apenas o que se afirma em
A síntese do trióxido de enxofre é um processo exotérmico

A dependência da constante de equilíbrio (Keq) com a temperatura é dada pela equação de van’t Hoff
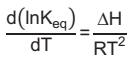
em que Keq é a constante de equilíbrio, ΔH é a entalpia da reação, R é a constante universal dos gases
(R = 8,3 J.mol-1.K-1) e T é a temperatura. Sabendo-se que Keq (300 K)=1 e considerando-se a entalpia da
reação aproximadamente constante nessa faixa de temperatura, o aumento da temperatura da reação de
20 °C desloca o equilíbrio da reação no sentido de formação dos
A adsorção é um fenômeno de superfície no qual espécies em fase líquida ou gasosa, chamadas adsorvatos, ligam-se à superfície do adsorvente por meio de interações físicas, químicas ou ambas. Além da catálise heterogênea, a adsorção também é aplicada à purificação de gases e a o tratamento de efluentes líquidos, entre outros usos. Para determinar o grau de recobrimento da superfície do adsorvente, como uma função da concentração do adsorvato no meio líquido ou gasoso, à temperatura constante, são estabelecidas as isotermas de adsorção.
O processo de adsorção pode ser representado por meio da seguinte equação
A + S ⇌ AS
em que A é o adsorvato, no estado líquido ou gasoso, S representa o sítio vazio na superfície do adsorvente e AS representa o sítio ocupado por A na superfície do adsorvente.
A adsorção de ácido acético em carvão ativado pode ser descrita pela isoterma de Freundlich, expressa pela seguinte equação
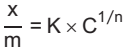
em que x é a massa de material adsorvido, m é a massa de material adsorvente, K e n são as constantes
do modelo e C é a concentração da solução (g.L-1) no equilíbrio. Os dados de equilíbrio para a adsorção de
ácido acético, a partir de soluções aquosas, em carvão ativado, são apresentados na figura a seguir.
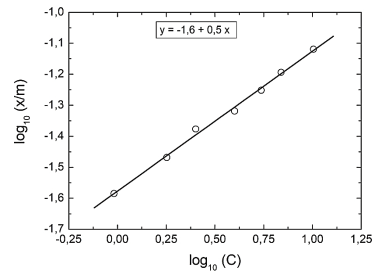
A partir dos dados apresentados no gráfico, é correto afimar que os valores das constantes K e n são,
respectivamente,
Um profissional do Corpo de Bombeiros Militar atua em diversas áreas de proteção e segurança da sociedade. Inicialmente, suas funções eram apenas de contenção e extinção de incêndios. Com o tempo, suas funções foram redefinidas, tornando-se um profissional responsável pela preservação do patrimônio ameaçado de destruição, salvamentos e conscientização civil das medidas básicas de segurança. Uma das áreas de atuação do Corpo de Bombeiros Militar é o salvamento em alturas, atividade de grande risco desenvolvida em locais de altitudes. O grande problema em atuar nessas áreas é que o indivíduo pode ficar sujeito a indisposição, dores de cabeça, náusea e cansaço devido ao ar rarefeito.
A equação química a seguir representa um sistema em equilíbrio envolvido na transformação da hemoglobina (Hm) em oxiemoglobina (HmO2 ) no sangue:
Hm (aq) + O2 (aq) ⇋ HmO2 (aq)
Sobre o processo de transformação de hemoglobina em oxiemoglobina na ação do profissional bombeiro em diferenças
de altitudes, assinale a alternativa incorreta.
O sulfito de sódio (Na2SO3 ) é um sal inorgânico muito utilizado como conservante de alimentos e na manufatura de papel. Um dos processos de produção do sulfito de sódio pode ser obtido mediante a seguinte equação na condição de equilíbrio químico.
Na2O(s) + SO2(g) ⇋ Na2SO3(s) ∆H < 0
Considerando que para a reação de produção em um processo industrial é desejável que se produza
mais sulfito de sódio partindo de um sistema em equilíbrio, qual fator é adequado para tal processo?
Em um experimento de química, um estudante colocou em um recipiente 500 mL de uma solução aquosa de hidróxido de sódio (NaOH) em uma chapa de aquecimento. O pOH da solução antes do aquecimento era igual a 2. Após um tempo, considerando que se evaporou apenas água, o pOH da solução se reduziu à metade.
Nessas condições, é correto afirmar que o volume, em mililitros, da solução que permaneceu no recipiente ao fim do experimento é igual a
Qual é o pH de uma solução de NaOH 2,0x10-5 M, considerando que a constante de dissociação da água é de 1,0x10-14 a 25° C?
Dados: log 5 = 0,7 e log 2 = 0,3.
O Cu4(OH)6(SO4) é um sal pouco solúvel em água, conforme descrito na equação química abaixo:
Cu4(OH)6(SO4)(s) ⇌ 4Cu2+(aq) + 6OH-(aq) + SO42-(aq)
Assumindo que a concentração do íon OH-, na solução saturada, permanece constante e igual a 1,0x106 M, qual é a fórmula do produto de solubilidade da reação e a concentração do íon sulfato, respectiva mente?
Dado:
Produto de solubilidade do Cu4(OH)6(SO4):Kps=2,56 x 10-69
Assinale a opção que completa corretamente as lacunas da sentença abaixo:
O cloreto de prata é menos solúvel em uma solução de NaCI do que em água pura. Nesse caso, a redução de solubilidade pode ser explicada pelo fenômeno denominado_______, baseado no_________.
Analise o seguinte equilíbrio:

Suponha que o valor da constante de equilíbrio é 300 a
600 K, e que a concentração das quatro espécies inicia-se
a 0,100 mol/L. Assinale a opção que apresenta de que
maneira essas concentrações mudarão, à medida que o
sistema se aproxima do equilíbrio, se a temperatura for
mantida a 600 K.
O hidróxido de magnésio é praticamente insolúvel na ausência de sais de amônio e tem um produto de solubilidade de 3,2x10-11 à temperatura ambiente. A dissociação desse hidróxido é representada por:
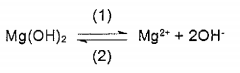
Calcule a concentração de íons hidroxila, em mol.L-1, em
uma solução aquosa saturada, e assinale a opção
correspondente.
