Questões Militares
Comentadas sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 153 questões
O palito de fósforo é um dos artigos mais úteis no nosso cotidiano. Na sua composição, possui fósforo vermelho, enxofre e clorato de potássio. A cabeça de um palito de fósforo pesa aproximadamente 0,05 g. A reação que ocorre na queima da cabeça de fósforo está representada a seguir:
3 P4 + S + 10 KClO3 + O2 → 3 P4O10 + 10 KCl + SO2
O cheiro característico de “fósforo queimado” se deve ao dióxido de enxofre formado.
Dados: No palito de fósforo, os componentes estão em quantidades estequiométricas. M (g mol-1): Cl = 35,5; K = 39; O= 16;P = 31; S = 32.
A massa (em g) de dióxido de enxofre produzido ao queimar uma cabeça de fósforo é aproximadamente:
“Gelo de fogo” escondido em permafrost é fonte de energia do futuro? Conhecido como "gelo que arde", o hidrato de metano consiste em cristais de gelo com gás preso em seu interior. Eles são formados a partir de uma combinação de temperaturas baixas e pressão elevada e são encontrados no limite das plataformas continentais, onde o leito marinho entra em súbito declive até chegar ao fundo do oceano. Acredita-se que as reservas dessa substância sejam gigantescas. A estimativa é de que haja mais energia armazenada em hidrato de metano do que na soma de todo petróleo, gás e carvão do mundo. Ao reduzir a pressão ou elevar a temperatura, a substância simplesmente se quebra em água e metano – muito metano. Um metro cúbico do composto libera cerca de 160 metros cúbicos de gás a pressão e temperatura ambiente, o que o torna uma fonte de energia altamente intensiva.
Disponível em: http://www.bbc.co.uk/portuguese/noticias/2014/04/140421_energia_metano_ms.shtml.
Acessado em 21/04/2014. Texto adaptado.
Dado: R = 8,2 x 10-5 m3 atm K-1 mol-1
Para armazenar todo o gás do interior de 1 m3 de “gelo de fogo” num cilindro de 1 m3 e a temperatura de 0°C, é necessária uma pressão (em atm) de
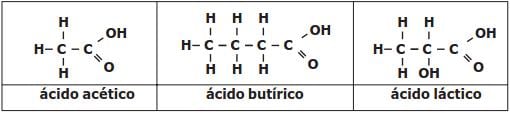
Com relação a estas substâncias citadas, são feitas as afirmativas abaixo.
I – Ácido Acético é a nomenclatura usual do composto que, segundo a nomenclatura oficial da União Internacional de Química Pura e Aplicada (IUPAC), é denominado de ácido metanóico.
II – As substâncias apresentadas possuem na estrutura grupos que caracterizam a função química ácido carboxílico.
III – O motivo de o ácido láctico apresentar maior ponto de fusão que o ácido butírico pode ser atribuído aos fatos de o ácido láctico ter maior massa molecular e de ser capaz de estabelecer maior número de fortes interações intermoleculares.
Dados:
- massas atômicas: C = 12 u ; H = 1 u; O = 16 u
Das afirmativas apresentadas está(ão) correta(s)
O texto a seguir serve como base para a resolução da questão.
O fosgênio é um gás extremamente venenoso, tendo sido usado em combates durante a
Primeira Guerra Mundial como agente químico de guerra. É assim chamado porque foi primeiro
preparado pela ação da luz do sol em uma mistura dos gases monóxido de carbono (CO) e cloro
(Cl2), conforme a equação balanceada da reação descrita a seguir: CO (g) + Cl2 (g) COCl2 (g).
O texto a seguir serve como base para a resolução da questão.
O fosgênio é um gás extremamente venenoso, tendo sido usado em combates durante a Primeira Guerra Mundial como agente químico de guerra. É assim chamado porque foi primeiro preparado pela ação da luz do sol em uma mistura dos gases monóxido de carbono (CO) e cloro (Cl2), conforme a equação balanceada da reação descrita a seguir: CO (g) + Cl2(g) → COCl2 (g).
Em um reator foram dispostos 560 g de monóxido de carbono e 355 g de cloro. Admitindo-se a reação entre o monóxido de carbono e o cloro com rendimento de 100 % da reação e as limitações de reagentes, a massa de fosgênio produzida é de
Dados:
- massas atômicas: C = 12 u ; Cl = 35,5 u; O = 16 u
Com base nas informações acima e na tabela periódica, incluída no final deste caderno de provas, julgue os itens a seguir.
Para combater a classe de incêndios gerados por esses materiais, deve-se empregar um extintor de pó químico elaborado à base de cloreto de sódio (NaCl).
Considerando o texto acima e os múltiplos aspectos que ele suscita, julgue os itens a seguir, utilizando, caso necessário, a tabela periódica inserida no final deste caderno de provas.
Considerando-se o valor aproximado de 6 × 1023 mol -1 para a constante de Avogadro, infere-se que, quando são colocados 1,8 × 1024 átomos de bário e 2 mols de gás oxigênio em reação, formam-se mais de 400 g de BaO.
Em 19,9 g de um sal de cálcio encontra-se 0,15 mol desse elemento. Qual a massa molar do ânion trivalente que forma esse sal?
Dado: Ca = 40 g/mol.
Dado: massa molar do Sulfato de Bário = 233 g/mol
CH4(g) + 2 O2(g) ->CO2(g) + 2 H2O(g) ΔH = -802 kJ
Se utilizarmos 4 mol de CH4 e 4 mol de O2 para uma nova reação, a quantidade de calor liberada será de
Em relação à concentração de uma das espécies resultante na mistura final, é CORRETO afirmar que
Dados:
Massas Atômicas: C = 12 u; O = 16 u e H = 1u;
Volume molar nas condições padrão=24,5 L·mol-1 .
Em relação à composição química elementar da madeira, pode-se afirmar que não há diferenças consideráveis, levando-se em conta as madeiras de diversas espécies. Os principais elementos existentes são: Carbono (C)48%, Hidrogênio (H)6%, Oxigênio (O) 44% e Nitrogênio (N) 1%; além destes elementos encontram-se pequenas quantidades de cálcio (Ca), potássio (K), magnésio (Mg) e outros, constituindo as substâncias minerais existentes na madeira.
Em um churrasco realizado por um certo gaúcho, em sua residência, foi consumido 1,7 Kg de madeira para assar toda a carne. Supondo que a combustão do carbono seja completa, a quantidade em matéria (mol) formada de gás carbônico será:
Dados: C=12g/mol.