Questões Militares de Química - Grandezas: massa, volume, mol, massa molar, constante de Avogadro e Estequiometria.
Foram encontradas 195 questões
FOLHA DE DADOS
Massas Atômicas (u):
O = 16
C = 12
S = 32
H = 1
Na = 23
Ni = 59
Ag = 108
U = 238
Dados Termodinâmicos:
R = 0,082 atm.L.mol-1.K-1 = 8,314 J.mol-1K-1
A taxa de emissão de dióxido de carbono em função do consumo médio de certo combustível, em um carro de testes, é apresentada a seguir.
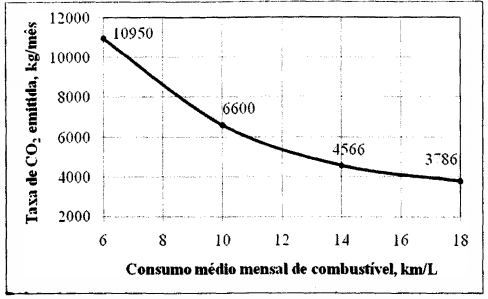
Para um consumo médio de 10 km/L, a massa total mensal de combustível consumida é 2175
kg. Dentre as opções abaixo, pode-se afirmar que o combustível testado foi o:
FOLHA DE DADOS
Massas Atômicas (u):
O = 16
C = 12
S = 32
H = 1
Na = 23
Ni = 59
Ag = 108
U = 238
Dados Termodinâmicos:
R = 0,082 atm.L.mol-1.K-1 = 8,314 J.mol-1K-1
Em 19,9 g de um sal de cálcio encontra-se 0,15 mol desse elemento. Qual a massa molar do ânion trivalente que forma esse sal?
Dado: Ca = 40 g/mol.
Um erlenmeyer contém 10,0 mL de uma solução de ácido clorídrico, juntamente com algumas gotas de uma solução de fenolftaleína. De uma bureta, foi-se gotejando uma solução 0,100 M de hidróxido de sódio até o aparecimento de leve coloração rósea. Nesse momento, observou-se um consumo de 20,0 mL da solução alcalina. Pode-se afirmar que a concentração de HCl na solução ácida original era de:
Dados:
Massas atômicas: H = 1,00 u, O = 16,0 u, Na = 23,0 u, Cl = 35,5 u