Questões de Concurso
Sobre farmacotécnica e tecnologia farmacêutica em farmácia
Foram encontradas 2.459 questões
( ) Todo processo de purificação de macromoléculas é suficiente para assegurar a ausência de vírus ativos no produto biológico terminado.
( ) Hemoderivados preparados a partir de macromoléculas termoestáveis podem ser submetidos a processos de inativação viral por aquecimento à temperatura de 60° C (± 0,5° C) por um período mínimo de uma hora.
( ) Agentes químicos podem ser utilizados em processos de inativação viral desde que exista método validado que assegure que estes sejam removidos ou estejam presentes nos produtos terminados em concentração segura.
( ) A inativação ou remoção viral é parte do processo produtivo de hemoderivados; mas tal etapa não requer condições assépticas, uma vez que ocorrerão terminalmente e asseguram também a esterilidade do produto terminado.
( ) Pasteurização, aquecimento a seco, aquecimento úmido, tratamento solvente-detergente e pH baixo são métodos de inativação viral. Precipitação, nanofiltração e cromatografia de afinidade são métodos de remoção viral.
A sequência está correta em
( ) O prazo de validade aprovado no registro do produto pode ser alvo de alteração pós-registro mediante apresentação de resultados dos estudos de estabilidade de longa duração pelo DRM.
( ) Não é permitido que produtos biológicos apresentem resultados de estudos de estabilidade reduzidos, delineados com base em sistemas de matrização ou agrupamento.
( ) Resultados de estudos de estabilidade de acompanhamento devem ser apresentados no Histórico de Mudanças do Produto (HMP), sendo requeridos para fins de registro.
( ) Estudos de ciclagem de temperatura avaliam o efeito da permanência dos produtos em condições distintas daquelas definidas para o transporte ou armazenamento, considerando desvios de temperatura previstos, sendo obrigatórios para o registro dos produtos.
( ) A definição dos cuidados de conservação prevista no pedido de registro se baseia nos resultados dos estudos de estabilidade de longa duração, considerando o prazo de validade proposto.
A sequência está correta em
I. Declaração de origem do plasma utilizado na fabricação do lote.
II. Certificado de liberação da sorologia do plasma utilizado na fabricação do lote.
III. Certificado de liberação do lote emitido pela autoridade sanitária do país de fabricação.
IV. Certificado de análise do controle de qualidade do plasma utilizado na fabricação do lote.
Está correto o que se afirma em
As Boas Práticas de Documentação (BPDoc) devem ser aplicadas de acordo com o tipo de documento. Devem ser implementados controles adequados para garantir precisão, integridade, disponibilidade e legibilidade dos documentos. As especificações devem ser semelhantes às especificações para matérias-primas, ou produtos acabados, conforme o caso. As especificações para produtos acabados devem incluir ou fazer algumas referências. Analise-as.
I. Nome do produto e código de referência, quando aplicável.
II. Fórmula.
III. Descrição da forma farmacêutica e detalhes da embalagem.
IV. Instruções para amostragem e análises.
V. Requisitos qualitativos e quantitativos com limites de aceitação.
VI. Condições de armazenamento e quaisquer precauções especiais de manuseio, quando aplicável.
VII. Prazo de validade.
Está correto o que se afirma em
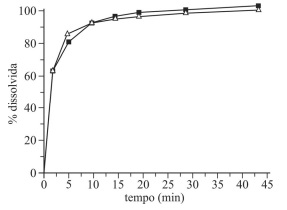
Com base nas informações e no gráfico anteriores, julgue o item que se segue.
O número de pontos de coleta desse estudo não foi
representativo do processo de dissolução, pois não se atingiu
o mínimo de dez tempos de coleta.

Com base nas informações e no gráfico anteriores, julgue o item que se segue.
Os perfis de dissolução indicam que os referidos
medicamentos são formas farmacêuticas de liberação
imediata.