Questões de Concurso Comentadas sobre química
Foram encontradas 7.347 questões
A cromatografia líquida com detecção por absorção molecular no ultravioleta-visível é uma técnica que apresenta alta eficiência para quantificação elementar de nitrogênio, enxofre, oxigênio e hidrogênio em compostos orgânicos.
Quanto maior for a diferença de tempo de retenção entre dois analitos em uma coluna cromatográfica maior será a resolução dessa coluna.
A maior limitação da cromatografia a gás está relacionada ao estado físico do analito, que deve ser uma substância gasosa a temperatura ambiente.
Considere que os seguintes valores tenham sido obtidos nas réplicas das medidas de concentração de Ag+ por voltametria: 20,8 mg/L; 20,5 mg/L; 20,1 mg/L; 20,7 mg/L; e 20,9 mg/L. Nessa situação, sendo a série de valores organizada por ordem de magnitude, a média dos valores obtidos será igual ao valor do dado central.
Considere que uma solução diluída que contenha uma espécie absorvedora, com coeficiente de absortividade molar igual a 5,0 × 102 L.mol-1.cm-1, tenha sido colocada em uma cubeta transparente de caminho óptico igual a 1,0 cm. Nessa situação, sabendo-se que, em determinado comprimento de onda, essa solução apresenta transmitância igual a 10,0%, a concentração da espécie absorvedora na solução será inferior a 0,005 mol/L.
A fotometria de chama é uma técnica de absorção atômica amplamente utilizada na química analítica para detecção de elementos de massa atômica reduzida como sódio, potássio, cálcio, nitrogênio, oxigênio e hidrogênio.
O pH de uma solução obtida pela mistura de 50 mL de NaOH 0,1 mol/L e 50 mL de HCl 0,25 mol/L é inferior a 2.
A estrutura abaixo representa o composto do frasco 8.
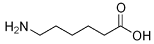
O modelo de hibridização é fundamental para explicar a formação de compostos que apresentam ligações iônicas.
A formação ou rompimento de ligação covalente é sempre um processo endotérmico.
A maior parte dos sólidos covalentes é de materiais amorfos, os quais apresentam unidades estruturais dispostas de forma desordenada.
A fórmula molecular H12C4O3 apresenta como fórmula mínima e fórmula percentual H4C2O1 e H9,09%C54,54%O36,36%, respectivamente.
Se 8 g de H2 reagem com 64 g de gás O2, produzindo 72 g de H2O, então a fórmula percentual é H11,11%O88,89%
Em uma reação química, a massa total de reagentes obrigatoriamente deve ser diferente da massa total dos produtos.
Acerca dessa situação hipotética, julgue o item a seguir.
A fim de se remediar o ocorrido no laboratório, deve-se adicionar sulfato de sódio em estado sólido à solução ácida derramada.
Acerca dessa situação hipotética, julgue o item a seguir.
Na situação em consideração, caso o ácido seja neutralizado parcialmente, será formado um sal ácido cuja nomenclatura será igual à daquele resultante da reação de neutralização total.
Acerca dessa situação hipotética, julgue o item a seguir.
Uma solução básica poderia ser utilizada sobre a solução ácida derramada, de modo a se formar, como produtos da reação de neutralização, sal e água.
A classificação periódica tem como base de organização o número atômico crescente dos elementos químicos, sendo possível, por meio dela, fazer previsões acerca das propriedades desses elementos.
Algumas propriedades periódicas, como o raio atômico e a energia de ionização, apresentam padrão de comportamento geral diferenciado se comparado ao padrão dos elementos de transição, principalmente os lantanídeos e os actinídeos.
A configuração eletrônica tem origem nos conhecimentos da mecânica quântica e permite explicar a ocorrência periódica das propriedades dos elementos.

