Questões de Concurso
Sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 612 questões
O detergente neutro é um produto químico de limpeza responsável pela higienização mais básica das superfícies e utensílios. O fato de ser neutro significa que o valor do seu pH é de:
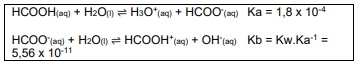
Calcule a concentração de íons hidrônio de uma solução tampão obtida pela mistura das soluções ácido fórmico 0,25 mol L-1 e formiato de sódio 0,9 mol L-1.
Em relação a esse fato, os valores de pH e pOH representam um modo de exprimir a [H+] de uma solução aquosa e, indiretamente, expressar também sua [OH-]. Assim, sabendo-se que uma pessoa diluiu 40.0 mL de seu suco gástrico (solução contendo ácido clorídrico), de pH = 1.0, ao tomar dois copos de água, levando a solução resultante a apresentar um volume final de 400.0 mL, caracterizando uma diluição, o pH da solução resultante logo após a ingestão da água será:
HInd + H2O → H3O+ + Ind– Ki = [HInd] / [H3O+] . [Ind–]
Sabe-se que o olho humano consegue identificar a mudança de cor quando:
[HInd] = 10[Ind–] cor A [Ind–] = 10[Hind] cor B
Assinale a alternativa que apresenta corretamente o intervalo de pH em que ocorre a mudança de cor de um indicador, cuja Ki = 10-7.

Nessas condições, o ácido mais fraco é o:
I. A temperatura crítica de pite é definida como a temperatura em que a corrente excede 100 microA/cm2 por 60s.
II. A temperatura crítica de pite é obtida através de técnica potenciodinâmica.
III. Em geral, o potencial crítico de pite diminui com o aumento da temperatura.
Dentre essas afirmativas, está(ão) correta(s)
O pH dessa solução é
Dado log 3 = 0,5
No que se refere à modificação de superfícies, julgue o seguinte item.
A engenharia de superfície envolve a alteração das
propriedades da fase a granel para reduzir a degradação do
material ao longo do tempo, o que é conseguido ao se tornar
a superfície maleável ao ambiente em que será usada.
Em uma titulação de neutralização é possível a representação gráfica do ponto final da titulação (pH x
titulante). Em uma titulação de NH4OH com HCl, o gráfico que representa a curva de titulação dessa
reação é
“Em uma solução ácida a concentração de íons hidrogênio (hidrônio) é maior do que a de íons hidróxido”.
Considerando uma solução de HCl de concentração 4,6.10-3 mol.L-1 (log 4,6 = 0,66), a alternativa que indica o pH e o pOH corretamente é:
(RUSSEL, Química Geral, vol. 2, Editora Pearson, 1994)
100 mililitros de uma solução de NaOH 0,01mol/l totalmente ionizada apresenta um pH
A concentração do íon hidrogênio [H+] no sangue é mantida dentro de limites estreitos no estado saudável. Em relação às desordens ácido-base, assinale a alternativa correta.
As antocianinas e seus derivados são pigmentos naturais polares da classe de compostos orgânicos chamados flavonoides e estão presentes nas uvas, sendo responsáveis pela cor do vinho tinto. Tais pigmentos são substâncias fenólicas que podem ter diversas cores, como vermelha, roxa, azul, e podem ser encontrados também em pétalas de flores, framboesa, figo, cereja, amora, beterraba, romã, maçã, cebola roxa, repolho roxo entre outros. O extrato aquoso obtido a partir do repolho roxo tem cor roxa e pH 7, a
 , contém antocianinas e pode apresentar o
seguinte comportamento a partir da adição de gotas de
soluções aquosas de substâncias com os seguintes valores
de pH:
, contém antocianinas e pode apresentar o
seguinte comportamento a partir da adição de gotas de
soluções aquosas de substâncias com os seguintes valores
de pH: 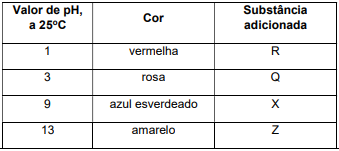
Pode-se verificar então que o extrato aquoso de repolho roxo funciona como um indicador de pH. A solução aquosa da substância R, adicionada a este extrato, pode ser de