Questões de Concurso
Sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 612 questões
FARIAS,R.F. Introdução à Química Forense. 3ª edição. Campinas, SP: Editora Átomo, 2010. p. 38-39 (adaptado).
Considere o pH 6,0 da urina um valor dentro dos padrões. A urina de um indivíduo que sofre de anorexia, após consumo de anfetamina, pode ter
“Apesar dos conceitos básicos de acidez e da capacidade de troca de cátions (CTC) serem bastantes conhecidos, tanto nas regiões de clima temperado como nas regiões de clima tropical, ainda existe muita confusão gerada pelo uso inadequado destes conceitos na solução de problemas ligados à fertilidade do solo”. (CAMARGOS, 2005)
Diante do exposto, analise as afirmativas abaixo.
I. Acidez ativa é dada pela concentração de H+ livre na solução do solo, que é liberada pelas substâncias que compõem a acidez potencial e é medida pelo valor de pH, em escala que, para a maioria dos solos do Brasil, varia de 4,0 a 7,5.
II. A acidez ativa é muito fácil de ser corrigida, pois em 1 ha com pH = 4,0, com 25% de água, precisa apenas de 2,5 kg de CaCO3 para ser corrigido. Porém, à medida que se neutraliza o H+ em solução, as substâncias que compõem a acidez potencial passam a liberar mais H+ que tende a manter, ao final de reações no solo, altos índices de acidez ativa.
Assinale a alternativa correta.
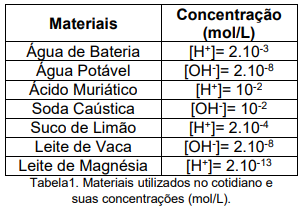
Ao observarmos os dados da tabela, assinale a alternativa correta em relação aos valores de pH dos materiais apresentados. Use: log2=0,3.
A ordem crescente de pKaH é:
Analisando as propriedades mencionadas no texto, para o grupo 12 e partindo do zinco em direção ao mercúrio, é possível prever tendência de:
(Dados, em g/mol; H=1, S=32 e O=16; log 2=0,3)
Dado: pKb NH4OH = 4,7
O aumento do pH da água é provocado por um ácido.
Considere as informações apresentadas no quadro a seguir para responder à questão abaixo :

I. O intervalo aceitável para o valor de pH no sistema de distribuição se situa entre 6,0 e 9,5.
II. A determinação da cor, turbidez e teor residual de desinfetante deve ser realizada em todas as amostras coletadas para análises microbiológicas.
III. A concentração mínima de cloro residual deve ser de 0,2 mg/mL em toda a extensão do sistema de distribuição; nos pontos de consumo deve ser de 2 mg/mL.
IV. A coleta de amostras para pesquisa de coliformes totais e Escherichia coli em mananciais superficiais deve ser realizada mensalmente e o volume mínimo de amostra a ser analisado deve ser de 1.000 mL.
V. Na água tratada para consumo humano, o parâmetro microbiológico para coliformes totais e Escherichia coli usado como indicador de contaminação fecal e de eficiência de tratamento é “ausência em 0,1 L de amostra”.
Está correto o que se afirma apenas em
Dentre os indicadores de pH, citam-se:
A fórmula química que representa sua estrutura é apresentada abaixo:
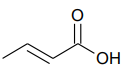
Uma solução aquosa de ácido crotônico foi preparada pela dissolução de 2,15g do ácido em água, sendo o volume final igual a 500mL.
[Dados: massas molares (em g.mol-1). C: 12; H: 1; O: 16.]
O pH dessa solução é igual a
De acordo com a Companhia Ambiental do Estado de São Paulo, CETESB, dentre os poluentes atmosféricos mais frequentes nos grandes centros urbanos, relata-se o monóxido de carbono, o dióxido de enxofre, o ozônio, o dióxido de nitrogênio e a amônia.
Dentre os poluentes atmosféricos relatados pela CETESB, o que pode causar a elevação dos valores de pH da água da chuva é a substância de massa molar igual a
Inúmeras especIes de plantas, flores e frutas possuem substâncias coloridas em sua seiva que mudam de cor conforme o pH do meio em que estão inseridas, sugerindo que tais espécies podem atuar como indicadores ácido-base. Os indicadores são substâncias capazes de mudar de cor dependendo das características físico-químicas da solução na qual estão contidas. Em relação aos indicadores ácido-base, é correto afirmar:
Em 1923, Brõnsted e Lowry propuseram que o aspecto essencial de uma reação ácido-base é a transferência de um próton de uma espécie para outra.
Dado o equilibrio: HCO3-(aq)+NH4(aq) ⇆ H2CO3(aq)+NH3(aq)
São considerados ácido conjugado e base conjugada de Brösted -Lowry, respectivamente, no equilíbrio dado acima: