Questões de Concurso
Sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 584 questões
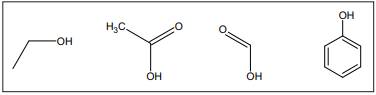
Em uma reação de esterificação, o pKa do catalisador é um fator muito importante para o melhor rendimento do produto de interesse. Dentre os compostos apresentados, a ordem crescente de pKa é:
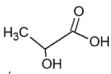
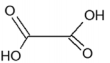
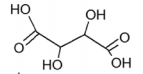
Ácido lático Ácido oxálico Ácido tartárico pKa = 3,85 pKa1= 1,25 ; pKa2 = 4,29 pKa1=3,04; pKa2=4,37
Em relação a esses ácidos, é CORRETO afirmar que
NaOH sólido; ácido acético (HAc) 2,00 mol L-1 (pKa = 4,74); ácido fosfórico (H3PO4) 2,00 mol L-1 (pKa1 = 2,23; pKa2 = 7,21; pKa3 = 12,32); amônia (NH3) 1,00 mol L-1 (pKa = 9,25); KH2PO4 sólido.
A mistura de quais dos reagentes acima, nas proporções adequadas, possibilita a preparação do tampão de pH 7,5, com boa capacidade de resistir às alterações de pH?
I. 100,00 mL de ácido acético (CH3 COOH) 0,124 mol L-1 (pKa = 4,74) com 25,00 mL de hidróxido de potássio (KOH) 0,248 mol L-1. II. 50,00 mL de hidróxido de amônio (NH4 OH) 0,02 mol L-1 (pKb = 4,74) com 50 mL de cloreto de amônio (NH4 Cl) 0,2 mol L-1. III. 25,00 mL de ácido perclórico (HClO4 ) 0,05 mol L-1com 50,00 mL de hidróxido de potássio (KOH) 0,04 mol L-1.
I- Os valores de ka e pKa não podem ser utilizados de forma quantitativa, somente qualitativa. II- De maneira genérica, a constante de dissociação de um ácido em água pode ser escrita como Ka = ([A- ] [H3O+ ]) / ([HA] [H2O]). III- Quanto maior o valor de Ka, maior é a força do ácido.
É correto o que se afirma em:
Considerando essa situação e o fato de que o experimento de titulação é uma das formas de se avaliar se uma solução apresenta propriedade tamponante, assinale a opção correta.
Os diversos componentes presentes na água, que alteram seu grau de pureza, podem ser retratados em termos de suas características físicas, químicas e biológicas. Essas características podem ser traduzidas na forma de parâmetros de qualidade da água. Acerca desse assunto, julgue o item seguinte.
O pH das águas naturais depende da presença de substâncias
dissolvidas que possuam propriedades ácido-básicas, e o seu
valor sofre influência da dissolução de rochas, da absorção de
gases da atmosfera, da oxidação da matéria orgânica e da
fotossíntese.
Desejando-se preparar um solução tamponada com pH 10,0, utilizando-se ácido bórico e borato de sódio, e sendo, para ácido bórico o pKa 9,24, calcule a razão, entre a base conjugada e o ácido, necessária para a preparação deste tampão.
O valor correto resultante do cálculo é
Sendo o Ka do ácido acético é 1,75 x 10-5 , calcule a concentração da solução de ácido acético e o pH após a adição de 18,00 ml de NaOH.
Os valores encontrados são, respectivamente,