Questões de Concurso
Sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 612 questões
Considere a reação química indicada a seguir.
HCO3 – + H+ ---> H2 CO3 H2O + CO2
A reação, da forma como está apresentada, ocorre nos
Massas atômicas: Br=79,9; H=1,0; O=16,0
HBrO(l) + H2O(1) ↔ H3O+(aq) + BrO-(aq)
O pH desta solução é:
São apresentadas as cores de indicadores ácido base em diferentes meios.
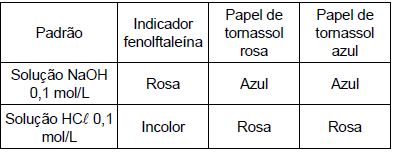
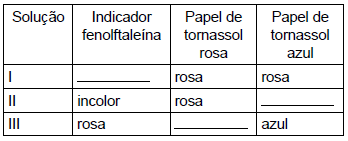
As soluções I, II e III apresentam, respectivamente, caráter

As soluções indicadas na tabela que apresentam iguais valores de pH são as soluções
Com relação à titulação de neutralização de um ácido fraco monoprótico por uma base forte, considere as afirmativas abaixo.
I No ponto de equivalência, o ácido fraco remanesce sem se ionizar.
II No ponto de equivalência, o pH será sempre maior que 7.
III Na metade do volume para o ponto de equivalência, o pH é igual ao pKa do ácido fraco.
IV Após o ponto de equivalência, o pH corresponde ao de uma solução tampão.
Das afirmativas, estão corretas
A química ácido-base de muitos sistemas de águas naturais, que inclui rios e lagos, é dominada pela interação do íon carbonato com o ácido carbônico, sendo o equilíbrio entre as espécies dependente do pH do meio. No gráfico abaixo, as espécies predominantes no sistema carbonato estão representadas por números 1, 2 e 3. Observando o gráfico, assinale a alternativa que correlaciona a numeração com a espécie, respectivamente.
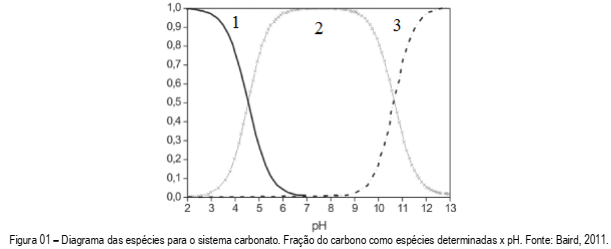
O denominado potencial hidrogeniônico (pH) ou índice de Sorensen é usado para realizar a medida da concentração de íons H+ . O valor do pH para uma solução de HCl 0,5M, cujo grau de ionização é de 80%, é de:
Dado: log 2 = 0,3.
Dado: K=39
Quanto à determinação do pH com o uso de eletrodo de vidro combinado, são feitas as seguintes afirmativas:
I. O eletrodo adequado para medidas de pH mede o potencial que se desenvolve através de uma fina membrana de vidro que separa duas soluções com diferentes concentrações do íon hidrogênio.
II. O eletrodo de referência gera uma tensão elétrica constante que não depende do pH.
III. O eletrodo de referência é constituído de um material inerte (vidro). A membrana desse eletrodo, que tem geralmente a forma de um bulbo, é feita a partir de um vidro especial.
IV. Os eletrodos são construídos com metais inertes, tais como: platina, ouro, paládio.
V. Em soluções com valores de pH abaixo de 0,5, o eletrodo de vidro típico exibe um erro de sinal oposto ao do erro alcalino.
Assinale a alternativa que apresenta a(s) afirmativa(s) INCORRETA(S).
A legislação ambiental de certos estados brasileiros não permite o lançamento em ambientes aquáticos de efluentes com pH inferior a 5,0 ou superior a 9,0. No que se refere à acidez, os efluentes líquidos das Indústrias A, B e C apresentam as seguintes concentrações:
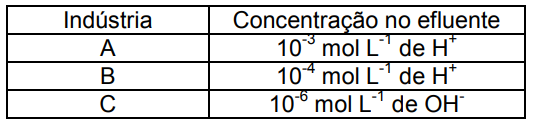
Considerando o quadro acima, poderiam ser lançados em ambientes aquáticos, sem tratamento, apenas os efluentes da(s) Indústria(s):
As aminas secundárias são bases fortes de Lewis. A dimetilamina (CH3 )2 NH, possui um pKb de 5,4.10-4 (fonte: J. Magalhães, Elementos 11º ano, Santillana, Carnaxide, 2008). Qual o pH, aproximado, de uma solução 0,3 mol.L-1 de dimetilamina, em água?
Dados: log1,264 = 0,102; 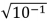 = 0,316.
= 0,316.