Questões de Concurso
Sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 612 questões
Um tampão foi preparado pela mistura de 0,20 mol de NH4Cl com 0,40 mol de NH3. O pH deste tampão, supondo-se um volume final de um litro, será aproximadamente
Dados: Kb (NH3) = 1,8 x 10-5
Adote log 3,6 = 0,56 ; log 2 = 0,30
As reações a seguir representam o sistema de tamponamento sanguíneo do bicarbonato.
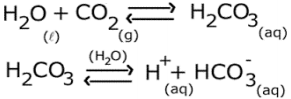
De acordo com as reações, o aumento de CO2 no sangue
resulta em
I. A solução tampão é uma solução em que o pH tende a permanecer o mesmo após a adição de pequenas quantidades de ácidos ou bases fortes. II. Os tampões são usados na calibração de medidores de pH, na cultura de bactérias e no controle do pH de soluções nas quais ocorrem reações químicas. III. Os tampões são geralmente preparados com concentrações iguais de ácido e de base forte, porque existe uma quantidade adequada de íons H+ e OH- .
É correto afirmar que:
A variação de pH de uma solução em relação ao volume de titulante adicionado pode ser observada nas curvas de titulação a seguir.
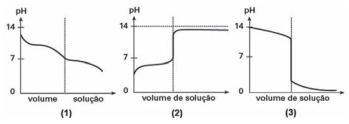
Assinale a alternativa correta.
75 mL de uma solução de HCl 0,100 mol L-1 foram misturados com 25 mL de uma solução de NaOH 0,100 mol L-1 . Considerando essas informações, o pH da solução final foi igual a:
Dado: log 5 = 0,70