Questões de Concurso
Sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 612 questões
Texto 19A1BBB
Um caminhão contendo ácido sulfúrico (H2SO4) concentrado tombou e seu conteúdo vazou sobre a rodovia e atingiu um pequeno lago nas imediações. Nos dias que se seguiram ao acidente, a análise da água do lago detectou uma concentração analítica do ácido igual a 1,00 • 10 2 mol/L. Visando-se a neutralizar a acidez causada na água do lago, um produto químico foi utilizado.
Para responder à questão, considere que a solução formada tenha comportamento ideal, que inicialmente a água se encontrava com pH neutro, que a primeira ionização do ácido sulfúrico seja completa e a segunda ionização seja parcial, e assuma 0,30 como o valor de log 2.
É comum, nos laboratórios químicos, efetuar a mistura de duas (ou mais) soluções de um mesmo soluto, ou a mistura de soluções cujos solutos reagem entre si. A respeito desse assunto e os cálculos relacionados, julgue o item a seguir.
A mistura das soluções de NH4
Cl e NaOH,
em proporções iguais, consiste em uma
solução tampão.
Como acontece com todas as ionizações, a água também se ioniza em um processo reversível até atingir um estado de equilíbrio, denominado equilíbrio iônico da água. A respeito dos conceitos do produto iônico da água e de pH e pOH, julgue o item a seguir. Dado: Kw = 1,0x10-14.
Em uma solução aquosa de ácido acético
0,1 mol/L que está 1,0% ionizado, o pH
dessa solução é igual a 3,0.
Como acontece com todas as ionizações, a água também se ioniza em um processo reversível até atingir um estado de equilíbrio, denominado equilíbrio iônico da água. A respeito dos conceitos do produto iônico da água e de pH e pOH, julgue o item a seguir. Dado: Kw = 1,0x10-14.
Uma solução aquosa que apresenta
concentração hidroxiliônica igual a
10-6 mol/L possui pH ácido.
Nesse contexto, os analisadores de pH
A fenolftaleína é um indicador ácido-base cuja faixa de viragem está descrita abaixo.
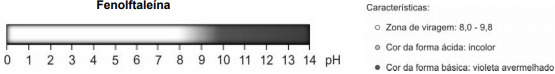
Espera-se observar a cor avermelhada ao colocar a fenolftaleína na solução resultante da mistura de água com
I. cloreto de amônio.
II. sódio metálico.
III. carbonato de sódio.
IV. sal de cozinha.
Está correto o que se afirma em
No que se refere aos ácidos e ao equilíbrio químico, julgue o próximo item.
Pela definição de Brønsted‐Lowry, um ácido é uma
espécie que tem a tendência de perder ou doar um
próton e uma base é uma espécie que apresenta a
tendência de receber ou adicionar um próton.
No que se refere aos ácidos e ao equilíbrio químico, julgue o próximo item.
Como a água é um eletrólito forte, sua ionização pode ser representada por: 2 H2O → H3O+ + OH− , sendo a constante de autoprotólise da água escrita por:
KW = [H3O+
]−1 ∙ [OH−]
−1.
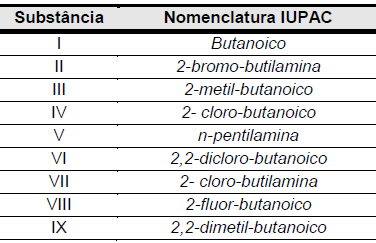
Considere as substâncias a seguir.
Um estudante misturou 50 mL de solução aquosa de ácido sulfúrico 0,10 mol/L com 50 mL de solução aquosa de hidróxido de sódio 0,40 mol/L e introduziu algumas gotas de fenolftaleina. O processo pode ser representado pela equação não balanceada:
H2SO4(aq) + NaOH(aq) → Na2SO4(aq) + H2O(l)
Ao término da reação, pode-se concluir acertadamente queConsidere as duas soluções aquosas ácidas apresentadas a seguir:
I. Ácido sulfúrico (H2SO4), um ácido forte (α = 100%), 0,1 mol/L.
II. Ácido acético (CH3COOH), um ácido fraco (α = 10%), 0,1 mol/L.
O pOH do ácido sulfúrico e o pH do ácido acético são respectivamente
A acidez do leite na amostra, expressa em porcentagem (massa/volume) é, aproximadamente:


Com relação à reação apresentada e às espécies nela envolvidas, e considerando a primeira constante de ionização ácida do H2O2 igual a 2,4 × 10-12, julgue o item a seguir.
Em solução aquosa com pH igual a 10,0, o grau de ionização
ácida do H2O2 é superior a 2,0%.
