Questões de Concurso
Sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 612 questões
O quadro a seguir apresenta o valor aproximado do pH do suco de algumas frutas.
Nome da fruta |
pH do suco |
abacaxi |
3,8 |
ameixa |
3,3 |
caju |
3,9 |
laranja |
3,4 |
limão |
2,3 |
mamão |
5,8 |
melancia |
5,3 |
Considerando os dados do quadro, assinale a alternativa que apresenta as frutas cujos sucos contêm as maiores concentrações de íons hidroxila.
As substâncias químicas são didaticamente agrupadas em funções, de acordo com suas propriedades físico-químicas. No entanto, ao passo do que é transmitido, via de regra, no ensino médio, estes agrupamentos não são tão rígidos. Com isso, uma substância classificada como base em uma reação pode agir como ácido em outra, a depender da teoria ácido/base empregada. Diante disso, analise as alternativas a seguir e assinale aquela que apresenta uma afirmação CORRETA.
O pH a 25 ºC de uma solução de ácido acético a 0,05 mol/L é: (Dado: Ka do ácido acético: 2x10-5 ).
O produto de solubilidade do hidróxido de cálcio é 1,2.10-6 , a 25 °C. Que valor o pH de uma solução contendo íons cálcio a 0,003 mol/L deve atingir para que o hidróxido de cálcio comece a precipitar a 25 ºC?
Dados: Ka = 8,4 x 10-4 Kw = 1,00 x 10-14 log 8,4 = 0,92
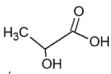
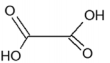
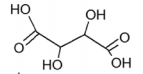
Ácido lático Ácido oxálico Ácido tartárico pKa = 3,85 pKa1= 1,25 ; pKa2 = 4,29 pKa1=3,04; pKa2=4,37
Em relação a esses ácidos, é CORRETO afirmar que
NaOH sólido; ácido acético (HAc) 2,00 mol L-1 (pKa = 4,74); ácido fosfórico (H3PO4) 2,00 mol L-1 (pKa1 = 2,23; pKa2 = 7,21; pKa3 = 12,32); amônia (NH3) 1,00 mol L-1 (pKa = 9,25); KH2PO4 sólido.
A mistura de quais dos reagentes acima, nas proporções adequadas, possibilita a preparação do tampão de pH 7,5, com boa capacidade de resistir às alterações de pH?
Julgue o item, relativos a ácidos e bases.
A solução‐tampão é aquela cujo pH é mantido constante quando pequenas quantidades de ácido ou base são adicionadas. Um tampão básico, que estabiliza soluções em pH > 7, é preparado com uma solução que contém CH3COOH e CH3CO2− .Julgue o item, relativos a ácidos e bases.
Indicadores ácido‐base são comumente utilizados nas
titulações de ácidos e bases, sejam fracos ou fortes. O
indicador é um ácido ou uma base cujas espécies
protonadas (ou desprotonadas) têm cores diferentes.
Em solução aquosa, o comportamento de um indicador
depende essencialmente do valor de pH.
Julgue o item, relativos a ácidos e bases.
Os ácidos fracos em solução aquosa não são
completamente dissociados, mas os ácidos com
constante de acidez (Ka) menor que 1 são
completamente dissociados para todas as
concentrações e podem ser considerados como ácidos
fortes.
Julgue o item, relativos a ácidos e bases.
Um ácido forte se ioniza completamente em água, o que
dá origem ao ácido conjugado do solvente, o íon H3O+
(ou simplesmente H+
). As bases fortes são compostos
iônicos no estado sólido e a dissolução em água envolve
a separação dos íons preexistentes.
Julgue o item de quanto às reações e aos usos que envolvem o carbonato de cálcio e seus derivados.
A correção da acidez do solo pode ser realizada com a
aplicação de calcário (calagem) e tem como objetivo
ajustar o pH do solo.
Com relação a esta temática, classifique os itens abaixo como Verdadeiros (V) ou Falsos (F):
( ) O pH é medido em uma escala de 0 a 14 e dependendo do valor é considerado ácido, neutro ou básico (também chamado de alcalino). ( ) Os ácidos são os mais próximos do 14. ( ) Os alcalinos são os mais próximos do 0. ( ) Os neutros são os com pH 7 ou aproximado a este valor. ( ) No sistema de distribuição de água, a portaria 2914 do Ministério da Saúde determina que o pH fique entre 6 e 9,5.
Assinale a sequência CORRETA:
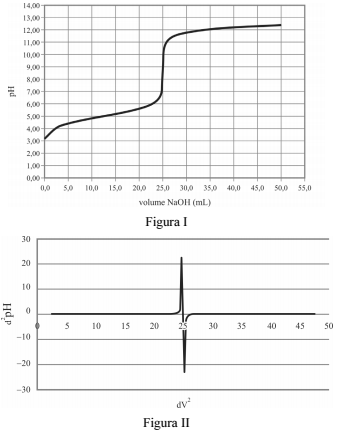
A figura I precedente mostra a variação do pH em função do volume de NaOH na titulação de 50,0 mL de uma solução de um ácido com uma solução de NaOH a 0,05 mol/L. A figura II mostra a segunda derivada da curva da figura I.
Considerando essas informações, assinale a opção correta a respeito
de volumetria e dos assuntos que esse tema suscita.
Texto 19A1BBB
Um caminhão contendo ácido sulfúrico (H2SO4) concentrado tombou e seu conteúdo vazou sobre a rodovia e atingiu um pequeno lago nas imediações. Nos dias que se seguiram ao acidente, a análise da água do lago detectou uma concentração analítica do ácido igual a 1,00 • 10 2 mol/L. Visando-se a neutralizar a acidez causada na água do lago, um produto químico foi utilizado.
Para responder à questão, considere que a solução formada tenha comportamento ideal, que inicialmente a água se encontrava com pH neutro, que a primeira ionização do ácido sulfúrico seja completa e a segunda ionização seja parcial, e assuma 0,30 como o valor de log 2.