Questões de Concurso
Sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 601 questões
Adaptado. Sala BioQuímica: Controle (e descontrole) do pH sanguíneo (salabioquimica.blogspot.com). Acesso em 25 de Julho de 2021.
A seguir, temos as reações de conversão do gás carbônico (CO2) em bicarbonato (HCO3 - ).
CO2 (g) + H2O (l) ↔ H2CO3 (aq) H2CO3 (aq) ↔ HCO3 – (aq) + H+ (aq)
Elas são a base para entendermos o comportamento desse sistema tamponado do sangue nos dois ambientes diferentes: no tecido muscular e nos alvéolos. Assim, de acordo com as características do controle de pH do sistema sanguíneo, assinale a alternativa correta.
Quanto ao equilíbrio químico e às características das soluções-tampão e das pilhas, julgue o item.
Uma solução-tampão resiste a mudanças de pH quando
um ácido ou uma base são adicionados. Um tampão
ácido estabiliza soluções em pH maior que 7 e um
tampão básico estabiliza soluções em pH menor que 7.
Uma solução que contenha CH3COOH e CH3CO2− é um
típico tampão básico.
Com relação ao assunto do texto anterior, julgue o item seguinte.
Durante a titulação do ácido acético com a soda, ocorre a
formação de uma solução tampão.
Com relação ao assunto do texto anterior, julgue o item seguinte.
O ácido acético é um ácido fraco.
HCI (aq) + KOH (aq) → KCI (aq) + H2O (I)
Após os cálculos, esse pós-graduando concluiu que o pH da solução resultante é igual a:
Dados: αHCl = 100%, Log 5 = 0,7 Massas Molares em g/mol: H = 1; O = 16; Cl = 35,5; K=39,1
(Dado log2 = 0,3)
(Dado: log 8,5 = 0,93)
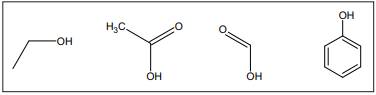
Em uma reação de esterificação, o pKa do catalisador é um fator muito importante para o melhor rendimento do produto de interesse. Dentre os compostos apresentados, a ordem crescente de pKa é:
O eletrodo de vidro é amplamente utilizado em laboratórios para a medição de pH. Esse é um eletrodo íon-seletivo ao H+. Entretanto, quando há baixa concentração de H+ e alta concentração de um outro íon específico, ocorre um desvio na medida do valor devido ao eletrodo responder a esse íon. Esse desvio é conhecido como erro alcalino. Sendo assim, qual íon que em alta concentração é responsável pelo erro alcalino?
Sendo uma solução aquosa em que pOH=5, é correto afirmar que:

Acerca do tema "pH e indicadores ácido-base", marque a alternativa correta: