Questões de Concurso
Sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 612 questões
Com referência aos conceitos de equilíbrio químico, julgue o item.
No equilíbrio químico, a energia potencial do sistema é máxima.
Nessa temperatura, o pKa desse ácido é igual a
Dado log 7 = 0,85
LOD = 3 x (desvio padrão do branco / inclinação da curva de calibração) LOQ = 10 x (desvio padrão do branco / inclinação da curva de calibração)
Considere que um procedimento de validação foi feito para determinar o LOD e o LOQ de um certo método analítico em espectroscopia de absorção atômica. Foram feitas dez medições do branco que, por sua vez, produziram valor médio = 4,24 x 10-3 com desvio padrão = 3,42 x 10-4 . A equação da reta da curva de calibração do método, com os seus respectivos coeficientes angular e linear, foi:
Absorbância = 3,42 x 10-3 conc. (mg L-1 ) + 2,23 x 10-3
O coeficiente de determinação (R2 ) da curva de calibração foi 0,9994. Com base nesses dados, os valores de LOD e de LOQ, em mg L-1 , foram, respectivamente,
(i) um ácido forte for adicionado?
(ii) uma base forte for adicionada?
1. Uma reação reversível atinge o equilíbrio quando as velocidades das reações direta e inversa se igualam.
2. As propriedades microscópicas do sistema como colisões, formação de complexos e transformações de substâncias permanecem constante, pois o equilíbrio é estático.
3. O equilíbrio químico só pode ser atingido em sistema fechado.
4. A concentração de cada substância do sistema permanece constante no equilíbrio.
Assinale a alternativa que indica todas as afirmativas corretas.
CH3COOH(aq) ⇄ CH3COO- (aq) + H+ (aq)
Dado: pH = -log [H+]
Suponha que foi preparada, em laboratório, uma solução aquosa de ácido acético 0,2 mol L-1. O pH dessa solução possui valor aproximado de
Como as soluções de hidróxido de sódio e ácido clorídrico foram destinadas apenas para correção de pH e, portanto, não precisam ser padronizadas, é adequado prepará-las pesando-se os reagentes comerciais correspondentes em balança semianalítica.
Para ser utilizado na aferição do pH das soluções, o ph-metro deve ser calibrado com, pelo menos, um padrão de calibração comercial, de preferência na região de pH alvo da solução a ser aferida.
MS(s) → M+2 + S–2 H2S → H+ + HS– HS– → H+ + S–2
Assinale a alternativa que apresenta corretamente a expressão que relaciona a solubilidade (s) do composto MS com o pH da solução.
Diante das informações e a partir dos seus conhecimentos, assinale a opção que mostra aproximadamente O VALOR DO pOH de uma solução de pH 8,50, a 37 °C:
Dados: densidade da água = 1000 g/L; massa molar da água = 18 g/mol; log(1,73) = 0,24; log(3) = 0,48.
Diante das informações, assinale a opção que mostra o valor do pH (após o equilíbrio) de uma solução em que são adicionados 0,01 mol/L de Zn2+ e 0,02 mol/L de OH- , a 25 °C: Dados eventualmente necessários: Kw (H2O), a 25 °C = 1,00 x 10-14; (3)1/3 = 1,44; log (1,44) = 0,16; log (2,88) = 0,46; (6)1/2 = 2,45; log (2,45) = 0,39; log (4,9) = 0,69.
H0 = pKa(BH+) - log [BH+] / [B]
onde B é um indicador básico, BH+ é o ácido conjugado desse indicador e pKa(BH+) é a constante de acidez deste último. Quando o indicador é nitroanilina (C6H6N2O2), experimentos realizados para ácidos puros nas mesmas condições, permitem construir a tabela abaixo:
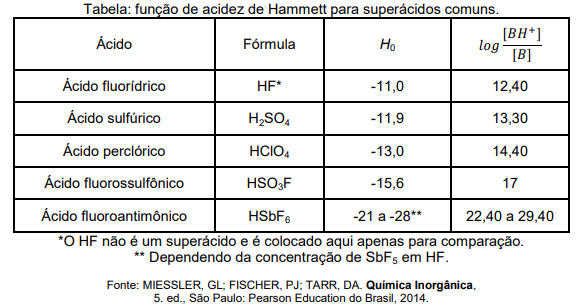
Diante dessas informações, assinale a opção que mostra a ÚNICA reação termodinamicamente espontânea entre pares das substâncias citadas acima:
Dado:
1- NaH2PO4 em água dissocia-se em Na+ e H2PO4 - e este dissocia-se, posteriormente, e HPO4 2- + H+ e tem um pKa de 6,82 a 25 0C.
2- antilog 1,18 = 15,14