Questões de Concurso
Sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 612 questões
O pH de um tampão preparado pela adição de 0,10 mol de ácido acético (HC2H3O2) e 0,10 mol de acetato de sódio (NaC2H3O2) aferido a 1 L com água destilada é de 4,74. O pH após a adição de 0,01 mol de NaOH e o pH caso o NaOH fosse substituído por 0,01 mol de HCl são, respectivamente:
Dados: Constante de ionização do ácido acético a 25ºC = 1,8 × 10–5; Produto iônico da água a 25ºC = 10–14; log 1,47 = 0,17; log 4,54 = 0,66
O azul-de-bromotimol é um indicador ácido-base, que apresenta faixa de viragem [6,0 - 7,6] predominando cor amarela em meio ácido (abaixo de 6,0), coloração verde em meio neutro (entre 6,4 e 7,2) e cor azul em meio básico (acima de 7,6). Considere a tabela abaixo com as seguintes espécies químicas e a cor correspondente na presença do indicador citado no texto. Assinale a alternativa que corresponde corretamente à coloração assumida pelo indicador a cada uma das respectivas substâncias.
Sabemos que existe a escala de acidez ou de pH onde verificamos se uma substância é ácida ou não, variando de 0 a 14. Quando os valores são abaixo de 7, temos substâncias ácidas, quando possuem pH igual a 7 são neutras e acima de 7 são básicas. A chuva geralmente tem pH em torno de 5,5, ou seja, ela é ácida, porém isso não traz nenhum dano ao ser humano. Quando falamos de chuva ácida, estamos falando em um pH entre 2 e 5, bastante ácido que pode afetar construções, plantações, a saúde humana entre outros. Uma amostra de água de chuva foi coletada com suspeita de pH em torno de 4,2. Com base nos valores de Kind dos indicadores abaixo, qual o mais adequado para verificar o valor do pH da água analisada?
Necessitando realizar um procedimento experimental durante uma aula de Bioquímica, um analista dissolveu 3,0 g de NH3 (MM= 17g/mol) e 3,0 g de NH4Cl (MM= 53,5 g/mol) em água suficiente para 250 mL de solução. O pH do tampão resultante deve ter valor mais próximo de:
Dado: Ka do NH4 + = 5,6 x 10-10
Solução-tampão é uma solução que contém, geralmente, um ácido fraco com um sal desse ácido, ou uma base fraca com o sal dessa base, com a finalidade de manter o pH de um sistema numa faixa adequada para realização de um experimento. Dentre os pares de espécies químicas abaixo relacionadas, todas serão adequadas para produzir um sistema tampão, EXCETO:
A maneira mais fácil de identificar um ácido ou uma base é utilizando um indicador, como por exemplo, o papel de tornassol. Indicador é toda substância que, dependendo do meio em que se encontra, pode mudar de cor. Quando mergulhamos o papel de tornassol em uma solução desconhecida, esse sofrerá alteração em sua coloração. Analise as afirmativas seguintes, relacionadas ao indicador, papel de tornassol e marque a alternativa CORRETA.
I. Se o papel de tornassol ficar vermelho, é sinal de que a substância é neutra.
II. Se o papel de tornassol ficar azul, é sinal de que a substância é básica.
III. Se a cor do papel de tornassol não se alterar, é sinal de que a substância é ácida.
I. 100,00 mL de ácido acético (CH3 COOH) 0,124 mol L-1 (pKa = 4,74) com 25,00 mL de hidróxido de potássio (KOH) 0,248 mol L-1. II. 50,00 mL de hidróxido de amônio (NH4 OH) 0,02 mol L-1 (pKb = 4,74) com 50 mL de cloreto de amônio (NH4 Cl) 0,2 mol L-1. III. 25,00 mL de ácido perclórico (HClO4 ) 0,05 mol L-1com 50,00 mL de hidróxido de potássio (KOH) 0,04 mol L-1.
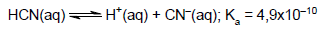
Considerando a equação que representa o equilíbrio desse ácido e sua constante de equilíbrio, conclui-se que esse ácido apresenta solução aquosa
A concentração é uma característica importante para análise e interpretações de propriedades para as soluções e um dado necessário para seu uso no laboratório, na indústria e no cotidiano.
Abaixo, estão desenhados recipientes com os respectivos volumes de solução e massas de hidróxido de sódio (NaOH = 40g/mol).
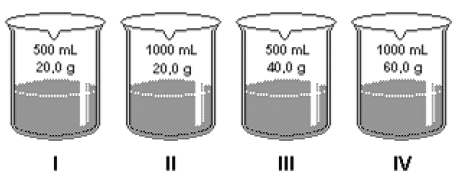
I. A solução contida no frasco I apresenta concentração de 1,0 mol/L;
II. As 4 soluções apresentarão pH acima de 7;
II. A solução mais concentrada está presente no frasco III.
São corretas as afirmações:
Na titulação de dois sucos de laranja com hidróxido de sódio, NaOH, 0,10 mol.L−1 foram obtidos os resultados abaixo.

Considerando apenas o ácido cítrico, um ácido triprótico, conclui-se que a laranja pera é
O pH de uma solução 0,001 mol/L de NaOH a 25 °C em relação a uma solução 0,0001 mol/L da mesma substância à mesma temperatura será
Dados:
Kw = 1,0 × 10−14