Questões de Concurso
Sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 584 questões
Durante uma vistoria, o fiscal analisa uma solução cuja concentração hidrogeniônica é igual a 4,5 x 10-8 íons-g/l. Qual é o valor do pH dessa solução?
Adotar: log(4,5) = 0,65
Em relação às propriedades gerais dos ácidos, sais e bases, considere as afirmativas:
I- Sais são substâncias iônicas que apresentam pelo menos um cátion diferente de H+ e pelo menos um ânion diferente de OH-.
II- O ácido deixa o indicador, papel de tornassol, azul.
III- A força de interação iônica de uma base independe do grau de solubilidade em água que ela apresenta.
Está(ão) correta(s) a(s) afirmativa(s)


De acordo com o gráfico acima e os conhecimentos sobre equilíbrio químico. Assinale a alternativa CORRETA:
O pKa é uma medida de quanto um ácido está ionizado. Considere as estruturas dos ácidos carboxílicos a seguir:
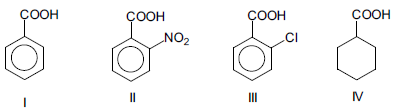
A ordem crescente de pKa dos ácidos apresentados é
Numa solução a concentração hidrogeniônica é 91 vezes maior que a hidroxiliônica.
O pH desta solução é (considere ℓog 3 = 0,5)
Considere a figura a seguir.
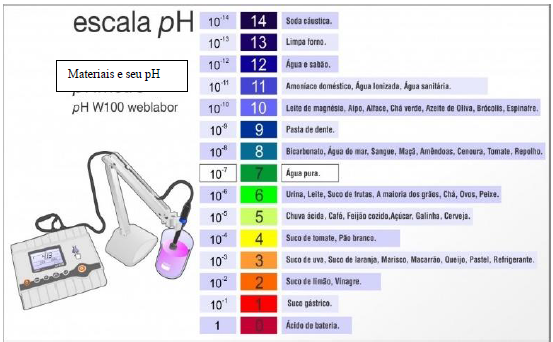
Disponível em: <http://www.blog.mcientifica.com.br/wp-content/uploads/2013/10/escala-de-ph-02-1024x582.jpg>. Acesso em: 2 out. 2016.
A figura apresenta a escala de pH de vários materiais conhecidos cotidianamente. Essa grandeza
No processo de tingimento de fibras de nylon, o efluente não tratado do banho de corante na fibra foi preparado com solução
tampão de ácido acético e acetato de sódio, em uma concentração de 0,60 g . e 1,64 g . L−1, respectivamente.
e 1,64 g . L−1, respectivamente.
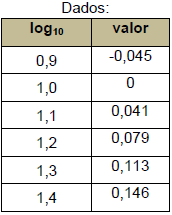
Dados:
log1 = 0; log0,5 = −0,3 log2 = 0,3
pKa do ácido acético = 4,74
massas molares (g.mol−1): ácido acético = 60; acetato de sódio = 82
O pH estimado do efluente será
Ao término de uma aula experimental, foi gerada uma solução aquosa com concentração de íons OH− igual a 1,0x10−2 mol.L −1. O técnico de laboratório providenciou a neutralização dessa solução e realizou o descarte adequado.
Com base nessa situação hipotética, assinale a alternativa que apresenta o pH dessa solução antes de ocorrer a neutralização.
Com relação a esse caso hipotético, é correto afirmar que o(a)
A tabela a seguir fornece os valores de pH ou pOH de soluções.

Arespeito da concentração molar de íons hidrogênio [H+] presente nas soluções, é CORRETO afirmar:
O ácido benzoico foi descoberto no século XVI e recebeu esse nome por ter sido extraído do benjoeiro.
Em 1875, Salkowski verificou que esse ácido atua como fungicida
e, desde então, o ácido benzoico vem sendo usado como
germicida na preservação de alimentos e como adjuvante
farmacológico anti-fúngico, normalmente em concentrações que
variam entre 0,05 a 0,15%. Trata-se de um composto de fórmula
molecular C7H6O2 (massa molar = 122 g.mo -1) pouco solúvel em
água.
-1) pouco solúvel em
água.
Em uma solução aquosa, comporta-se como um ácido fraco, com pKa = 4.
Uma solução aquosa de ácido benzoico em concentração 0,12%
(m/v) apresenta pH aproximadamente igual a