Questões de Concurso
Sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 584 questões
Sobre potenciometria, considere as afirmativas a seguir.
I. Em um eletrodo redox, um metal inerte está em contato com uma solução contendo as espécies oxidadas e reduzidas da meia-reação redox.
II. O potencial de Junção Líquida é o causado pela pressão osmótica na interface do eletrodo e deve ser subtraído do potencial medido em soluções concentradas em íons divalentes.
III. Eletrodos de referência devem apresentar potencial fixo e estável e não devem ser afetados pela passagem das pequenas quantidades de corrente elétrica que ocorrem quando se realizam as análises.
IV. Em soluções-teste com pH acima de 9, a presença de íons como o sódio ou o potássio pode resultar em desvios na determinação do pH, registrando valores superiores ao pH real.
Assinale:
Um químico desejava preparar 500 mL de uma solução de hidróxido de amônio (NH4OH) 0,10 mol/L pela diluição de uma solução estoque de NH4OH que, segundo o rótulo do frasco, apresenta concentração 30% em m assa e densidade 0,895 g/mL. Com base nesses dados, o químico realizou o cálculo do volume da solução estoque a ser em pregado e preparou a solução. Como a amônia é um a substância altamente volátil, o químico julgou conveniente aferir a concentração da solução resultante realizando a titulação de 20,0 mL dessa solução com uma solução padrão de HC1 0,090 mol/L.
Considerando que, a 25 °C, a constante de basicidade do NH4OH é igual a 1,8 x 10 5 e a constante de autoprotólise da água, definida como o produto das atividades dos íons hidróxido e hidrônio, é igual a 1,0 x 10-14 , e atribuindo comportamento ideal para todas as soluções envolvidas, julgue o item seguinte, tendo o texto apresentado como referência.
O indicador ácido-base mais apropriado para a detecção do
ponto final da titulação deve apresentar a faixa de viragem em
pH ácido.
Ao final, ele obteve um suco com concentração hidrogeniônica de
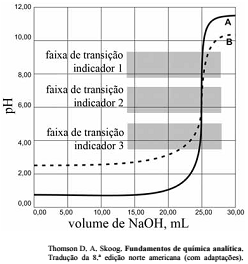
As titulações são amplamente utilizadas em química para identificar os ácidos, as bases, os oxidantes, os redutores, os íons metálicos e as proteínas. Com base nessas informações e na figura acima que apresenta um gráfico de titulação de NaOH, pH em função do volume em mL, julgue o item a seguir.
Qualquer um dos três indicadores ácido base mostrados na
figura podem ser usados para titulação de soluções mais
diluídas.
2KNO3(s) + S(s) + 3C(s) → K2S(s) + N2(g) + 3CO2(g)
Com base nessas informações, julgue o item seguinte.
O nitrato reage com a água conforme a reação NO3 – + H2O → NO3 + OH– , aumentando significativamente o pH da solução formada, haja vista que o caráter básico do OH– é mais forte que o caráter ácido do NO3 – .
O teor de ferro em dois frascos (A e B) de um medicamento, presente na forma de sulfato ferroso, foi determinado por meio de volumetria de oxidação-redução, utilizando-se KMnO4 0,01 mol/L como titulante, em meio ácido. O frasco A estava lacrado e o frasco B encontrava-se aberto, com menos da metade de seu volume inicial. Para a análise, 5,00 mL do medicamento de cada frasco foram diluídos em água e o volume, completado para 100,00 mL. Em seguida, alíquotas de 30,00 mL das soluções resultantes foram acidificadas com H2SO4 e diretamente tituladas em triplicata com o KMnO4. A tabela abaixo mostra os volumes médios de permanganato gastos e seus desvios padrões em mL.

Com base nessas informações, julgue o próximo item.
Uma solução de amido 1% (m/m) pode ser utilizada como
indicador para essa titulação.
2KNO3(s) + S(s) + 3C(s)-> K2S(s) + N2(g) + 3CO2(g).
Com base nessas informações, julgue o item seguinte.
O nitrato reage com a água conforme a reação NO3 – + H2O -> 6 HNO3 + OH– , aumentando significativamente o pH da solução formada, haja vista que o caráter básico do OH– é mais forte que o caráter ácido do NO3 – .
Quando um sal se dissolve em água, a solução pode ser ácida, básica ou neutra, dependendo da natureza do sal. Sabendo disso, é correto afirmar que a hidrólise do acetato de amônio (NH4C2H3O2) em água resulta em uma solução:
(Dado: Ka do ácido acético = 1,8 x 10-5 e Kb da
amônia = 1,8 x 10-5).
Uma solução tampão foi preparada a partir da mistura de uma solução 1,00 M de hidróxido de amônio (NH4OH) com uma solução 1,00 M de cloreto de amônio (NH4Cl), totalizando 1,0 litro. Em seguida foi adicionado 0,20 mol de OH- a solução tampão e o pH calculado. Sabendo que o valor de pKb é igual a 4,74, o pH da solução após a adição de 0,20 mol de OH- é igual a:
(Dado Kb:1,8 x 10-5; log de 0,66 = - 0,176)
Equação 1
2C15H14O3(s) + Na2CO3(aq) ⇔ 2C15H13O3-Na+ (aq) + CO2(aq) + H2O(ℓ)
composto amarelo-claro, insolúvel em água sal de sódio do lapachol, vermelho, solúvel em água
Equação 2
C15H13O3-Na+ (aq) + HCl(aq) ⇔ C15H14O3(S) + NaCl(aq)
Através da análise das equações 1 e 2 acima é INCORRETO afirmar:
O professor está programando a sua aula de titulação e precisa escolher qual o indicador ácido-base que usará para indicar o final da titulação entre solução aquosa de ácido clorídrico (titulante) e hidróxido de potássio. Dentre as opções que ele dispõe e que estão listadas abaixo, qual a melhor para esta titulação?
Indicador Zona de viragem
Violeta de metila (amarelo) 0,0 – 1,6 (azul-púrpura)
Azul de bromotimol (amarelo) 3,0 – 4,6 (violeta)
Alaranjado de metila (vermelho) 3,4 – 4,4 (amarelo)
Fenolftaleína (incolor) 8,2 – 10,0 (rosa)
Carmin de indigo (azul) 11,4 – 13,0 (amarelo)
Indique, dentre os ácidos listados abaixo, aquele cuja base conjugada será a mais forte:
ácido Ka
Acético 1,75 x 10-5
Bórico 6,4 x 10-10
Benzoico 6,3 x 10-5
Lático 1,4 x 10-4
Oxálico 6,5 x 10-2