Questões de Concurso
Sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 612 questões
O funcionamento apropriado desse tipo de eletrodo depende de
HA (aq)
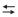 H+(aq)+ A-(aq),
H+(aq)+ A-(aq), onde a constante de equilíbrio é 1,0 x 10-5 .
Ao se dissolver 0,10 mol de HA em água, formando 1,0 L de solução, no equilíbrio tem-se pH mais próximo de
Um estudante investigou as propriedades físicas e químicas de um gás e em seguida preparou um relatório, no qual anotou o seguinte:
1. O gás é incolor e inodoro.
2. Quando borbulhado em um frasco contendo água de cal, (solução de hidróxido de cálcio), a solução fica turva, devido à formação de um precipitado branco leitoso.
3. Quando borbulhado em um frasco contendo água destilada, a solução resultante é levemente ácida.
4. O gás extingue a chama de uma vela acesa.
5. O gás é o dióxido de carbono.
Considere que uma solução levemente ácida apresenta, a 25 ºC, variação de uma unidade de pH em relação à solução neutra (pH 7,0).
Para confirmar a informação referente à baixa acidez da solução conforme descreve o item 3 do relatório, o indicador mais adequado é
I o azul de timol em pH acima de 2,8 tem a cor vermelha.
II o vermelho de metila em pH acima de 6,2 tem a cor vermelha.
III o amarelo de alizarina em pH acima de 11,0 tem a cor violeta.
IV o alaranjado de metila em pH abaixo de 3,1 tem a cor vermelha.
V o tornassol tem a cor vermelha em pH abaixo de 4,5.
Das afirmativas acima, estão INCORRETAS:
(Dado: densidade da solução =1 e I = 127)
SACAROSE C12H22O11 Constante crioscópica e ebuloscópica para água: 1,86 kg/mol e 0,51 kg/mol Densidade da água e do etanol: 1,0 g/cm³ e 0,78 g/cm³ |
FOSFATO DISSÓDICO Na2HPO4 MM = 142,0 g/mol constante do produto de solubilidade: 0,63 a 25º C FOSFATO MONOSSÓDICO NaH2PO4 ⇔ Na+ + H+ + HP4 MM = 120,0 g/mol pKa = 6,8 |
Considerando as informações fornecidas nos quadros e no gráfico acima, julgue os itens que se seguem.
O valor do pOH de uma solução de fosfato monossódico é reduzido com a adição de cloreto de sódio.
SACAROSE C12H22O11 Constante crioscópica e ebuloscópica para água: 1,86 kg/mol e 0,51 kg/mol Densidade da água e do etanol: 1,0 g/cm³ e 0,78 g/cm³ |
FOSFATO DISSÓDICO Na2HPO4 MM = 142,0 g/mol constante do produto de solubilidade: 0,63 a 25º C FOSFATO MONOSSÓDICO NaH2PO4 ⇔ Na+ + H+ + HP4 MM = 120,0 g/mol pKa = 6,8 |
Considerando as informações fornecidas nos quadros e no gráfico acima, julgue os itens que se seguem.
O pH de uma solução 0,2 M de fosfato monossódico, que contenha 99 mL, se reduz pela adição de 0,5 mL de ácido clorídrico 0,1 M.
De acordo com as funções inorgânicas, julgue os itens seguintes.
Sendo o Kb da CH3NH2 igual a 3,6. 10-4, o pH da reação de protonação de uma solução 0,2 M de metil amina em água será menor que 10.
Texto 5, para as questões 31 e 32
Considerando as informações do texto 5 e conhecimentos correlatos, julgue os itens a seguir.
I - A presença de Fe II ou Fe III está ligada a um processo redox e também á presença ou não de oxigênio, visto que é sabido que a oxidação de Fe (II) a Fe(III) é muito rápida em meio aeróbico.
II - O aumento da concentração de oxigênio atmosférico no hipolímnio favorece a presença de Fe3+ e Mn4+ no sedimento.
III - O grau de redução do manganês e do ferro no sedimento independe da presença e da quantidade de carbono orgânico.
IV- Os óxidos e hidróxidos de Fe3+ e Mn 4+ têm baixa solubilidade em pH > 6,0.
A quantidade de itens certos é igual a
Uma das etapas do tratamento da água é a desinfecção, sendo a cloração o método mais empregado. Esse método consiste na dissolução do gás cloro numa solução sob pressão e sua aplicação na água a ser desinfectada. As equações das reações químicas envolvidas são:
Cl2 (g) + 2H2O (l) HCIO (aq) + H3O+ (aq) + Cl- (aq)
HCIO (aq) + H2O (l) H3O+ (aq) +CIO- (aq) pKa = -log Ka =7,53
A ação desinfetante é controlada pelo ácido hipocloroso, que possui um potencial de desinfecção cerca de 80 vezes superior ao ânion hipoclorito. O pH do meio é importante, porque influencia na extensão com que o ácido hipocloroso se ioniza.
Para que a desinfecção seja mais efetiva, o pH da água a ser tratada deve estar mais próximo de
Ao organizar uma bancada, um professor derrubou acidentalmente uma solução alcoólica de fenolftaleína. Após jogar detergente, com o intuito de limpar a bancada, o professor notou que a parte molhada com fenolftaleína tornou-se rosa.
Em face dessa situação, é correto concluir que o detergente
Basicamente, existem dois tipos de pólvora: a pólvora negra e a pólvora sem fumo. Quase todas as armas de fogo modernas usam a pólvora sem fumo. A pólvora negra, classificada como explosivo, é composta por enxofre, carvão e nitrato de potássio. Entre as várias reações que ocorrem na explosão da pólvora negra, a mais simples está descrita pela seguinte equação química:
2KNO3(s) + S(s) + 3C(s) 6 K2S(s) + N2(g) + 3CO2(g).
Com base nessas informações, julgue o item.
O nitrato reage com a água conforme a reação
NO3 – + H2O-> HNO3 + OH– ,
aumentando significativamente o pH da solução formada,
haja vista que o caráter básico do OH–
é mais forte que o
caráter ácido do NO3
–
.
Basicamente, existem dois tipos de pólvora: a pólvora negra e a pólvora sem fumo. Quase todas as armas de fogo modernas usam a pólvora sem fumo. A pólvora negra, classificada como explosivo, é composta por enxofre, carvão e nitrato de potássio. Entre as várias reações que ocorrem na explosão da pólvora negra, a mais simples está descrita pela seguinte equação química.
2KNO3(s) + S(s) + 3C(s) → K2S(s) + N2(g) + 3CO2(g)
Com base nessas informações, julgue o item seguinte.
O nitrato reage com a água conforme a reação
NO3– + H2O → HNO3 + OH– ,
aumentando significativamente o pH da solução formada,
haja vista que o caráter básico do OH–
é mais forte que o
caráter ácido do NO3–
.