Questões de Concurso
Sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 612 questões
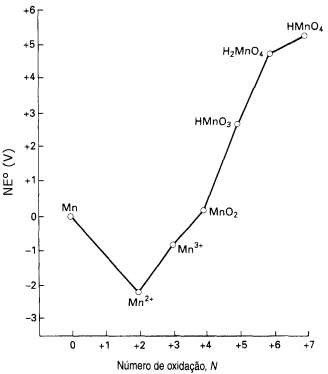
Fonte: SHRIVER, D. F.; ATKINS, P.W, C.H. Química Inorgânica, 3ª edição, Porto Alegre:
A partir da análise do diagrama, pode-se afirmar que a espécie de manganês que se apresenta com o estado de oxidação mais estável em meio ácido, e uma das espécies de manganês que sofre desproporcionamento espontaneamente são, respectivamente,
Dados: Mg = 24,3 g mol -1 ; H = 1,0 g mol -1 ;Cl = 35,5 g mol -1 ; log 2=0,30.
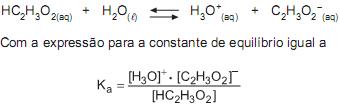
Princípio de Le Chatelier: “Se um sistema em equilíbrio é submetido a uma perturbação, o sistema se ajusta de modo a contrapor os efeitos da perturbação e alcançar uma nova situação de equilíbrio”.
Com base nesse princípio, na expressão da constante Ka, e considerando temperatura e força iônica constantes, após a adição de 1 mL de solução aquosa de NaOH 1 mol/L à solução contendo acetato de sódio e ácido acético, uma nova situação de equilíbrio seria alcançada após o(a)
Qual o valor da constante de ionização Ka desse ácido?
HCN ⇌ H+ + (CN) -
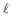 foram consumidos.
foram consumidos. Qual a relação molar NaOH/Na2 CO3 presente na solução analisada?
Os pKs das carboxilas das cadeias laterais desses aminoácidos são respectivamente 5,9 e 4,5.
Sabe-se que o pH ótimo para a atividade da lisozima é 5,2. Nessa situação, é correto afirmar que os estados de ionização do Glu35 e Asp52 serão, respectivamente:


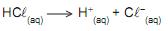
O volume, em mL, de solução aquosa de HCL0,1 mol/L necessário para o preparo de 1 L de solução com pH = 3 é
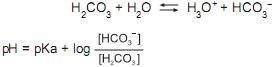
Sobre o equilíbrio de um sistema contendo 100 mL de solução 0,1 mol/L de H 2CO3 e 0,1 mol/L de HCO3– , quando se adiciona(m)