Questões de Concurso
Sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 584 questões
Sabendo que, a 25 °C,
H3 PO4(aq)
 H3 O+ (aq) + H2 PO4 – (aq) Ka = 7,6 x10–3
H3 O+ (aq) + H2 PO4 – (aq) Ka = 7,6 x10–3H2 O ( l )
 H3 O+ (aq) + OH– (aq) Kw = 1,0 x 10–14
H3 O+ (aq) + OH– (aq) Kw = 1,0 x 10–14estima- se que o pH da solução aquosa de NaH2 PO4 , a 25 ºC, deve ser próximo a

Quanto maior for o valor da constante de ionização básica, maior será o valor do pH.
O ácido acético (HC2H3O2), um dos principais componentes do vinagre, apresenta Ka = 1,8.10 -5 , sendo, por isso, classificado em ácido fraco, embora sua base conjugada C2H3O- 2 seja forte.
I. Cloreto de potássio.
II. Carbonato de sódio.
III. Cloreto de amônio.
IV. Acetato de sódio.
V. Fluoreto de lítio.
quais as soluções aquosas dos sais referidos que vão apresentar um pH acima de 7?
Dado: log 0,625 = – 0,2
HC2 H3 O2(aq) + H2 O(l)
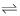 H3 O+ (aq) + C2 H3 O2 - (aq)
H3 O+ (aq) + C2 H3 O2 - (aq) Com o objetivo de estudar a variação do valor do pH (capacidade freadora ou de tamponamento) dessa solução, um técnico fez experiências adicionando a três alíquotas da solução um volume específico das seguintes substâncias: (i) água pura, (ii) uma solução aquosa de base forte e (iii) uma solução aquosa de ácido forte.
Considerando esse equilíbrio e as condições externas que podem perturbá-lo até que se atinja um novo equilíbrio, constata-se que na adição de 10,0 mL de
Soluções Cor da solução na presença Cor da solução na presença Cor da solução na presença
azul de bromotimol de alaranjado de metila de fenolftaleína
1 amarela vermelha —
2 azul amarela —
3 amarela amarela incolor
4 verde — incolor
De acordo com os resultados, o técnico concluiu que as soluções 1, 2 , 3 e 4 eram, respectivamente,
Dados
cores dos indicadores em diferentes faixas de pH (valores aproximados).
Azul de bromotimol Alaranjado de metila Fenolftaleína
pH < 6,0 – cor amarela pH ≤ 3,1 – cor vermelha pH < 8,2 – incolor
pH entre 6,0 e 7,6 – cor verde pH entre 3,2 e 4,4 – cor laranja pH entre 8,2 e 10,0 – cor rosa claro
pH > 7,6 – cor azul pH > 4,4 cor amarela pH > 10 cor rosa intenso
O funcionamento apropriado desse tipo de eletrodo depende de
I. As titulações são baseadas em uma reação entre o analito e um reagente padrão.
II. A titulação volumétrica envolve a medida de volume de uma solução de concentração conhecida necessária para reagir completamente com o analito.
III. Na titulação coulométrica, o “reagente” é uma corrente elétrica direta constante de grandeza conhecida que consome o analito.
IV. Em qualquer titulação o ponto de equivalência química, experimentalmente chamado de ponto final, é assinalado pela variação da cor de um indicador ou da resposta de um instrumento.
Estão corretas as afirmativas:
NH4 + (aq) + H2O(l) NH 3 (aq) + H3O+ (aq) Ka = 5,70 x 10-10
NH 3 (aq) + H2O(l) NH4+ (aq) + OH- (aq) Kb = 1,75 x 10-5
Sabe-se que
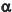 0 e
0 e 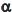 1 são as frações da concentração total da espécie não dissociada e CT (concentração total) é a soma das concentrações analítica das espécies e sua espécie conjugada.
1 são as frações da concentração total da espécie não dissociada e CT (concentração total) é a soma das concentrações analítica das espécies e sua espécie conjugada.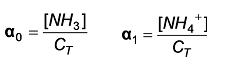
Indique a alternativa correta para quando este sistema possuir os valores de
 0 e
0 e  1 iguais.
1 iguais.
HA (aq)
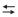 H+(aq)+ A-(aq),
H+(aq)+ A-(aq), onde a constante de equilíbrio é 1,0 x 10-5 .
Ao se dissolver 0,10 mol de HA em água, formando 1,0 L de solução, no equilíbrio tem-se pH mais próximo de
Um estudante investigou as propriedades físicas e químicas de um gás e em seguida preparou um relatório, no qual anotou o seguinte:
1. O gás é incolor e inodoro.
2. Quando borbulhado em um frasco contendo água de cal, (solução de hidróxido de cálcio), a solução fica turva, devido à formação de um precipitado branco leitoso.
3. Quando borbulhado em um frasco contendo água destilada, a solução resultante é levemente ácida.
4. O gás extingue a chama de uma vela acesa.
5. O gás é o dióxido de carbono.
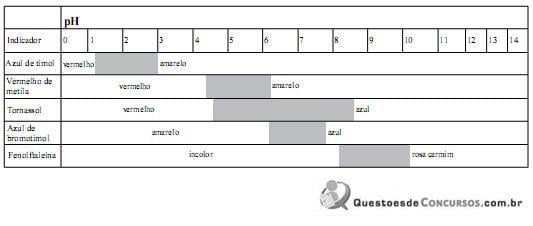
Considere que uma solução levemente ácida apresenta, a 25 ºC, variação de uma unidade de pH em relação à solução neutra (pH 7,0).
Para confirmar a informação referente à baixa acidez da solução conforme descreve o item 3 do relatório, o indicador mais adequado é