Questões de Concurso
Sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 612 questões
O pH do solo influencia também na coloração das flores de algumas espécies de plantas, a exemplo das hortênsias, que, em solos ácidos, produzem flores azuis e, em solos alcalinos, flores cor de rosa.
Considerando-se as informações do texto e a relação entre o valor de pH é a concentração de íons H3O+ e OH− , em soluções aquosas, é correto concluir:
Para uma solução contendo íons carbonato, bicarbonato, OH⁻ e H⁺, a alcalinidade total é definida por:
alcalinidade total = 2[CO₃²⁻] + [HCO₃⁻] + [OH⁻] – [H⁺]
O indicador fenolftaleína é usado para determinar a concentração de carbonato, CO₃ ²⁻, e é denominado de alcalinidade à fenolftaleína:
alcalinidade à fenolftaleína = [CO₃²⁻]
Calcule a alcalinidade total de uma amostra de água de rio cuja alcalinidade à fenolftaleína é 3,0×10⁻⁵ mol·L⁻¹, cujo pH é 10,0, e cuja concentração do íon bicarbonato é 1,0×10⁻⁴ mol·L⁻¹.
Um técnico de laboratório necessita preparar 500 mL de uma solução tampão de pH = 7,2, em que a soma das concentrações do ácido e de sua base conjugada deva ser 0,100 mol  L-1 . Para isso, o técnico tem à sua disposição as soluções de ácido fosfórico (H3PO4; pKa1 = 2,12; pKa2 = 7,20; e pKa3 = 12,67) de concentração 0,500 mol
L-1 . Para isso, o técnico tem à sua disposição as soluções de ácido fosfórico (H3PO4; pKa1 = 2,12; pKa2 = 7,20; e pKa3 = 12,67) de concentração 0,500 mol  L-1 e NaOH 1,00 mol
L-1 e NaOH 1,00 mol  L-1. Considerando essa situação e as informações apresentadas, julgue o item a seguir, com relação a preparo, aplicação e equilíbrios químicos envolvidos em soluções tampões.
L-1. Considerando essa situação e as informações apresentadas, julgue o item a seguir, com relação a preparo, aplicação e equilíbrios químicos envolvidos em soluções tampões.
Caso a solução tampão mencionada, com pH = 7,2, tenha sido
preparada pelo técnico, é correto afirmar que ela possui uma
capacidade tamponante maior para pequenas adições de base
do que para pequenas adições de ácido.
Um técnico de laboratório necessita preparar 500 mL de uma solução tampão de pH = 7,2, em que a soma das concentrações do ácido e de sua base conjugada deva ser 0,100 mol  L-1 . Para isso, o técnico tem à sua disposição as soluções de ácido fosfórico (H3PO4; pKa1 = 2,12; pKa2 = 7,20; e pKa3 = 12,67) de concentração 0,500 mol
L-1 . Para isso, o técnico tem à sua disposição as soluções de ácido fosfórico (H3PO4; pKa1 = 2,12; pKa2 = 7,20; e pKa3 = 12,67) de concentração 0,500 mol  L-1 e NaOH 1,00 mol
L-1 e NaOH 1,00 mol  L-1. Considerando essa situação e as informações apresentadas, julgue o item a seguir, com relação a preparo, aplicação e equilíbrios químicos envolvidos em soluções tampões.
L-1. Considerando essa situação e as informações apresentadas, julgue o item a seguir, com relação a preparo, aplicação e equilíbrios químicos envolvidos em soluções tampões.
A partir das soluções descritas no texto, é possível o preparo
de uma solução tampão que seja adequada para tamponar um
sistema em pH = 11.
Um técnico de laboratório necessita preparar 500 mL de uma solução tampão de pH = 7,2, em que a soma das concentrações do ácido e de sua base conjugada deva ser 0,100 mol  L-1 . Para isso, o técnico tem à sua disposição as soluções de ácido fosfórico (H3PO4; pKa1 = 2,12; pKa2 = 7,20; e pKa3 = 12,67) de concentração 0,500 mol
L-1 . Para isso, o técnico tem à sua disposição as soluções de ácido fosfórico (H3PO4; pKa1 = 2,12; pKa2 = 7,20; e pKa3 = 12,67) de concentração 0,500 mol  L-1 e NaOH 1,00 mol
L-1 e NaOH 1,00 mol  L-1. Considerando essa situação e as informações apresentadas, julgue o item a seguir, com relação a preparo, aplicação e equilíbrios químicos envolvidos em soluções tampões.
L-1. Considerando essa situação e as informações apresentadas, julgue o item a seguir, com relação a preparo, aplicação e equilíbrios químicos envolvidos em soluções tampões.
Para o preparo da referida solução tampão, serão necessários
100 mL de ácido fosfórico e mais de 70 mL de hidróxido de
sódio.
Um técnico de laboratório necessita preparar 500 mL de uma
solução tampão de pH = 7,2, em que a soma das concentrações do
ácido e de sua base conjugada deva ser 0,100 mol  L-1
. Para isso,
o técnico tem à sua disposição as soluções de ácido fosfórico
(H3PO4; pKa1 = 2,12; pKa2 = 7,20; e pKa3 = 12,67) de concentração
0,500 mol
L-1
. Para isso,
o técnico tem à sua disposição as soluções de ácido fosfórico
(H3PO4; pKa1 = 2,12; pKa2 = 7,20; e pKa3 = 12,67) de concentração
0,500 mol  L-1 e NaOH 1,00 mol
L-1 e NaOH 1,00 mol  L-1. Considerando essa situação
e as informações apresentadas, julgue o item a seguir, com relação
a preparo, aplicação e equilíbrios químicos envolvidos em soluções
tampões.
L-1. Considerando essa situação
e as informações apresentadas, julgue o item a seguir, com relação
a preparo, aplicação e equilíbrios químicos envolvidos em soluções
tampões.
Considere que o tampão tenha sido preparado pelo técnico e
utilizado para tamponar uma reação que produziu
2,0 × 10-2 mol de H+ após 2 horas de reação. Em face dessa
situação, é correto concluir que o tampão continua ativo e
trabalhando dentro da sua faixa de uso.
O coordenador de um laboratório decide utilizar uma técnica eletroquímica para realizar a determinação de chumbo em amostras de efluente. Com base nessa informação, julgue o item seguinte acerca de eletroquímica.
Aferições de pH em soluções são comumente realizadas
utilizando-se um potenciômetro conectado a um eletrodo de
vidro combinado, o qual é composto, resumidamente, por dois
eletrodos de prata-cloreto de prata e pela membrana de vidro.
O coordenador de um laboratório decide utilizar uma técnica eletroquímica para realizar a determinação de chumbo em amostras de efluente. Com base nessa informação, julgue o item seguinte acerca de eletroquímica.
Quando são realizadas medidas com o eletrodo de vidro de
soluções muito ácidas, podem ser observados valores de pH
menores que os reais, que são conhecidos como erros ácidos.
Sua principal origem consiste na saturação da membrana de
vidro por íons H+
.
O gráfico acima mostra os espectros UV-VIS da forma ácida (--) e básica (-) de um ácido monoprótico que apresenta pKa = 3,5 e massa molar = 150,00 g/mol. Com base nessas informações, julgue o item subsequente, acerca da espectroscopia de absorção molecular na região ultravioleta/visível e da determinação dessas espécies por essa técnica espectroscópica.
Em comparação com a espécie básica, a espécie ácida
apresenta espectro mais característico e possui uma banda de
absorção que possibilita o desenvolvimento de um método
mais sensível para a determinação do composto.
O teor de cálcio em uma amostra de água de rejeito industrial foi determinado por volumetria de complexação. Na análise, transferiram-se para um erlenmeyer 5,00 mL da amostra, 5,00 mL de solução tampão, 10,00 mL de uma solução de complexo magnésio-EDTA e uma ponta de espátula de negro de eriocromo. Em seguida, procedeu-se a titulação com 38,0 mL de uma solução padrão de EDTA 0,01 mol/L. Considerando essas informações, julgue o item subsequente, com relação à análise de cálcio na água descrita acima, à volumetria e aos equilíbrios de complexação.
Titulações de complexação com EDTA devem ser realizadas
com pH controlado, preferencialmente pH ácido, para evitar a
formação de hidróxidos dos metais de interesse.
O teor de cálcio em uma amostra de água de rejeito industrial foi determinado por volumetria de complexação. Na análise, transferiram-se para um erlenmeyer 5,00 mL da amostra, 5,00 mL de solução tampão, 10,00 mL de uma solução de complexo magnésio-EDTA e uma ponta de espátula de negro de eriocromo. Em seguida, procedeu-se a titulação com 38,0 mL de uma solução padrão de EDTA 0,01 mol/L. Considerando essas informações, julgue o item subsequente, com relação à análise de cálcio na água descrita acima, à volumetria e aos equilíbrios de complexação.
Sabendo-se que as constantes de formação dos complexos de
Mg2+ e Zn2+ com EDTA são 4,9 × 108
e 3,2 × 1016,
respectivamente, é correto afirmar que o pH mínimo necessário
para a realização da titulação de complexação de Zn2+ é menor
que o do cátion Mg2+.
Em meio aquoso, ele se ioniza de acordo com a equação simplificada (I) abaixo.
(I) HC2H3O2(aq)
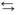 H+(aq) + C2H3O2−(aq)
H+(aq) + C2H3O2−(aq) Ácido clorídrico é um ácido muito forte e, em meio aquoso, ele se ioniza de acordo com a equação simplificada (II) abaixo.
(II) HCl(aq) → H+(aq) + Cl−(aq)
Na reação da base forte hidróxido de sódio 0,1 mol/L com o ácido etanoico 0,1 mol/L, e com o ácido forte
 0,1 mol/L, ambos em meio aquoso, ocorrem as seguintes reações:
0,1 mol/L, ambos em meio aquoso, ocorrem as seguintes reações: (III) NaOH(aq) + HC2H3O2(aq) → NaC2H3O2(aq) + H2O(l)
(IV) NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l)
Sobre a ionização em (I) e (II) e as reações de neutralização em (III) e (IV), tem-se que:
Frasco 1: pH = 2
Frasco 2: pH = 12
Frasco 3: pH = 7
Frasco 4: pH = 4
Frasco 5: pH = 10
A partir dos valores de pH obtidos, o técnico deve ter concluído que a substância possivelmente presente no frasco
Considerando os limites desse método e os resultados experimentais dessa análise, a concentração em g/L, de NaCl na amostra é
Dado: M(NaCl) = 58.5 g/mol
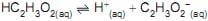
A constante de equilíbrio desse ácido fraco foi determinada experimentalmente medindo-se o pH de uma solução aquosa de ácido acético 0,1 mol/L.
O pH medido foi igual a 3; logo, a constante de equilíbrio,
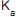 é, em módulo, aproximadamente igual a
é, em módulo, aproximadamente igual a I. Cloreto de potássio.
II. Carbonato de sódio.
III. Cloreto de amônio.
IV. Acetato de sódio.
V. Fluoreto de lítio.
quais as soluções aquosas dos sais referidos que vão apresentar um pH acima de 7?
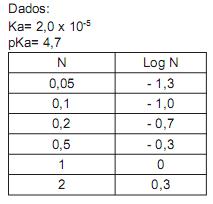
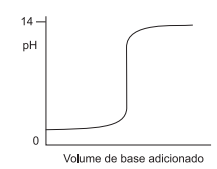
Considere a curva de titulação produzida quando uma base forte é adicionada a um ácido forte.
O pH da solução, quando 50 mL da base forte de concentração de 0,1 mol/L são adicionados a 51 mL do ácido forte de concentração de 0,1 mol/L, é de
A eventual dissolução de nitrato de amônio em água causaria a diminuição do pH da água.

