Questões de Concurso
Sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 612 questões
Sobre potenciometria, considere as afirmativas a seguir.
I. Em um eletrodo redox, um metal inerte está em contato com uma solução contendo as espécies oxidadas e reduzidas da meia-reação redox.
II. O potencial de Junção Líquida é o causado pela pressão osmótica na interface do eletrodo e deve ser subtraído do potencial medido em soluções concentradas em íons divalentes.
III. Eletrodos de referência devem apresentar potencial fixo e estável e não devem ser afetados pela passagem das pequenas quantidades de corrente elétrica que ocorrem quando se realizam as análises.
IV. Em soluções-teste com pH acima de 9, a presença de íons como o sódio ou o potássio pode resultar em desvios na determinação do pH, registrando valores superiores ao pH real.
Assinale:
Um químico desejava preparar 500 mL de uma solução de hidróxido de amônio (NH4OH) 0,10 mol/L pela diluição de uma solução estoque de NH4OH que, segundo o rótulo do frasco, apresenta concentração 30% em m assa e densidade 0,895 g/mL. Com base nesses dados, o químico realizou o cálculo do volume da solução estoque a ser em pregado e preparou a solução. Como a amônia é um a substância altamente volátil, o químico julgou conveniente aferir a concentração da solução resultante realizando a titulação de 20,0 mL dessa solução com uma solução padrão de HC1 0,090 mol/L.
Considerando que, a 25 °C, a constante de basicidade do NH4OH é igual a 1,8 x 10 5 e a constante de autoprotólise da água, definida como o produto das atividades dos íons hidróxido e hidrônio, é igual a 1,0 x 10-14 , e atribuindo comportamento ideal para todas as soluções envolvidas, julgue o item seguinte, tendo o texto apresentado como referência.
O indicador ácido-base mais apropriado para a detecção do
ponto final da titulação deve apresentar a faixa de viragem em
pH ácido.
 3C(g) a 523 K, contido em um recipiente de 2 L, h 1, 2 e 4 mols dos gases A, B e C, respectivamente, no equilíbrio. Nessa situação, considerando R = 0,08 atm × L × mol -1 × K-1 e que todos os gases são ideais, os valores de KC e Kp são, respectivamente, iguais a
3C(g) a 523 K, contido em um recipiente de 2 L, h 1, 2 e 4 mols dos gases A, B e C, respectivamente, no equilíbrio. Nessa situação, considerando R = 0,08 atm × L × mol -1 × K-1 e que todos os gases são ideais, os valores de KC e Kp são, respectivamente, iguais a A esse respeito, analise as afirmativas a seguir.
I. A 30ºC, o pH neutro é 6,92.
II. A 10ºC, o pH neutro é 7,27.
III. Mesmo a temperaturas diferentes de 25ºC, o pH neutro não se altera.
Assinale:
 isoladamen- te ou em combinação compatível, foram tituladas com HCl 0,1000 mol L-1 usando a fenolftaleína como indicador. Outras alíquotas de 25,00 mL das mesmas soluções foram tituladas usando dessa vez o verde de bromocresol como indicador. Os resultados das titulações estão expressas na tabela abaixo.
isoladamen- te ou em combinação compatível, foram tituladas com HCl 0,1000 mol L-1 usando a fenolftaleína como indicador. Outras alíquotas de 25,00 mL das mesmas soluções foram tituladas usando dessa vez o verde de bromocresol como indicador. Os resultados das titulações estão expressas na tabela abaixo.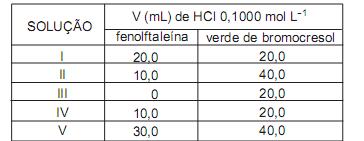
Sabendo que o intervalo de pH de mudança de cor da fenolftaleína é 8,2 - 10,0 e do verde de bromocresol é 3,8 - 5,4, a solução que apresenta corretamente as massas, em mg, dessas espécies em 25,00 mL, de acordo com os dados das titulações, é
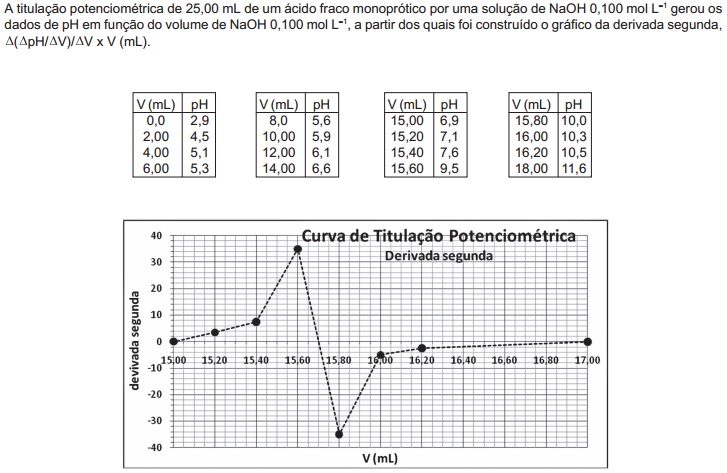
De acordo com os dados da tabela e do gráfico acima, o volume de equivalência e o valor do pKa desse ácido fraco são,respectivamente,
A partir dessas informações e assumindo que a acidez do hidrolisado foi decorrente exclusivamente da dissociação do ácido sulfúrico, qual foi a quantidade de hidróxido de cálcio utilizada na neutralização?
O reagente de Nessler é uma solução alcalina de tetraiodomercurato de potássio que, ao reagir com o radical amônia, forma um complexo de coloração amarela e fórmula HgI2.HgNH2I. A carne em início de deterioração e que apresente cor amarela neste teste deverá ter nível de pH
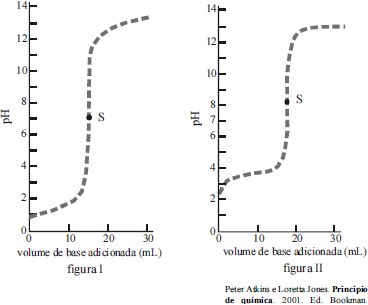
Uma das técnicas usadas na determinação da concentração de um soluto é a titulação. Essa técnica é utilizada com frequência em laboratórios de pesquisa, indústria e laboratórios de análises clínicas e forense. Com base na técnica de titulação e nas figuras I e II acima, assinale a opção correta:
A respeito da classificação das substâncias e suas características, julgue os itens.
A respeito da classificação das substâncias e suas características, julgue os itens.