Questões de Concurso
Sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 612 questões
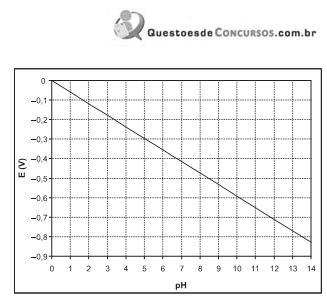
Sobre a transformação da água em gás hidrogênio, por um processo de oxidação/redução, considere as afirmativas abaixo.
I – O uso de qualquer agente oxidante provoca a liberação do gás hidrogênio, independente do valor do pH da solução.
II – Para pH igual a seis, a liberação de gás hidrogênio só será observada se o outro reagente apresentar potencial do eletrodo menor que, aproximadamente, – 0,35 V.
III – A liberação de gás hidrogênio em meio fortemente ácido só será observada se a espécie que irá reagir apresentar potencial do eletrodo positivo.
IV – Existem metais capazes de provocar a liberação de gás hidrogênio, mesmo com o valor de pH igual a 14.
Estão corretas APENAS as afirmativas
Dado: pF = -log [F- ]
Sobre essa análise potenciométrica, afirma-se que o(a)
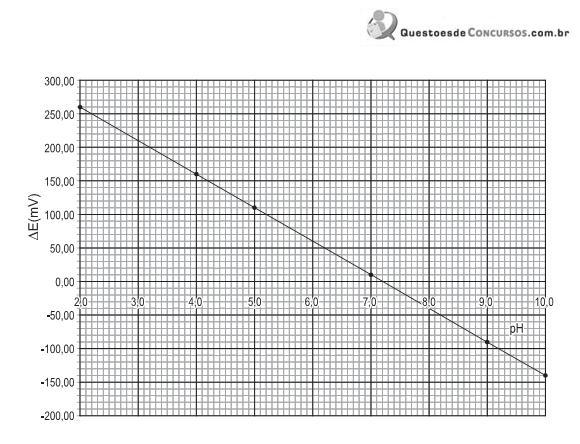
A partir da análise do gráfico, o módulo do fator de resposta, em mV/pH, é
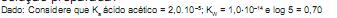
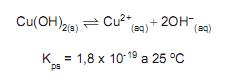
Sendo o valor do pH ideal da água da piscina igual a 6, a quantidade máxima de CuSO4 . 5H2 O em massa, que deve ser adicionada a uma piscina de volume igual a 10.000 L, com água no pH ideal, em kg, é
Etapa I - Adição de quantidade conhecida de Ag+ para garantir a reação completa com todo íon haleto (X- ) e excesso de Ag+ na solução Ag+(aq) + X- (aq) → AgX(s)
Etapa II - Titulação do excesso de Ag+
Ag+ (aq) + SCN-(aq) → AgSCN(s)
Etapa III - Formação de complexo vermelho com o primeiro excesso de SCN-
SCN- + Fe3+→ [(Fe(SCN)] 2+(aq)
Com base nas informações relativas a cada etapa do processo, analise as afirmações a seguir.
I - O SCN- atua como indicador do ponto ? nal da titulação.
II - Pelo fato de o valor do
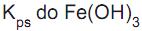 do Fe(OH) 3 ser 4 x 10-38 , o método de Volhard só funciona se o pH da solução for muito ácido.
do Fe(OH) 3 ser 4 x 10-38 , o método de Volhard só funciona se o pH da solução for muito ácido. III - O
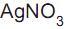 é um padrão primário, pois sofre alteração fotoquímica quando exposto à luz.
é um padrão primário, pois sofre alteração fotoquímica quando exposto à luz. IV - Nas titulações argentométricas, os sais de prata tipo AgX são bem solúveis em água.
É correto APENAS o que se afirma em
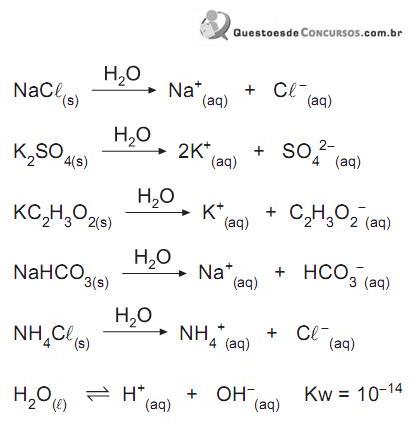
Considerando os íons dos sais que reagem com a água (hidrólise) e os que não reagem, afirma-se que a solução aquosa de
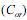 e na fase aquosa
e na fase aquosa 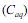 , quando atingido o
, quando atingido o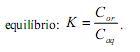
Dois estudantes realizaram a extração de um composto, a partir de uma solução aquosa com a concentração do composto igual a 0,0100 mol/L. O estudante A realizou uma única extração, utilizando 100 mL da solução aquosa e 100 mL de 1-octanol, e o estudante B utilizou o mesmo volume da solução aquosa, mas realizou duas extrações consecutivas, cada uma com 50 mL de 1-octanol.
Considerando o conjunto de informações apresentado acima e que o coeficiente de partição do composto no sistema 1-octanol/água seja igual a 2,0, julgue os itens que se seguem.
Caso o composto seja um ácido que sofra ionização em água, então, a fração extraída será tanto maior quanto mais elevado for o pH da fase aquosa.
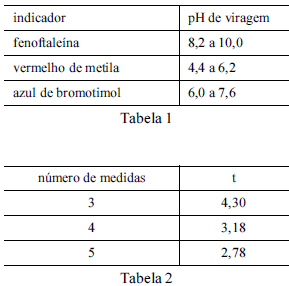
Considere que uma solução de NaOH foi padronizada por meio da titulação, em quadruplicata, com 20,00 mL de uma solução padrão de biftalato de potássio 0,1000 mol/L e que a concentração média encontrada para a solução de NaOH foi de 0,080 mol/L, com uma estimativa do desvio padrão de ±0,002 mol/L. Considere, ainda, a tabela 1, em que é apresentado o pH de viragem de alguns indicadores ácido-base, e a tabela 2, em que são apresentados os valores do parâmetro t de student para uma probabilidade de 95%.
Com base nessas informações, julgue os itens seguintes
Entre os indicadores apresentados na tabela 1, o mais
adequado à titulação em questão é o vermelho de metila.
Preparou-se 100 mL de uma solução padrão de biftalato de potássio, de acordo com o seguinte procedimento: (i) pesagem de um béquer vazio em uma balança analítica; (ii) pesagem do béquer contendo 2,0000 g do biftalato na mesma balança; (iii) dissolução do biftalato, por meio da adição de água suficiente ao béquer; (iv) transferência de todo o conteúdo do béquer para um balão volumétrico de 100,00 mL; (v) preenchimento do balão com água até o menisco.
Considerando as informações acima e que os desvios padrão sejam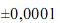 g, para uma simples leitura na balança utilizada, e
g, para uma simples leitura na balança utilizada, e 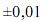 mL, para uma leitura de menisco no balão, julgue o próximo item.
mL, para uma leitura de menisco no balão, julgue o próximo item.
O desvio padrão relativo para a concentração da solução de biftalato de potássio preparada é maior que 1,0×10-4 .
água. Essa substância é também a mais abundante no organismo
humano. Sendo a água tão comum, tem-se a tendência de considerar
triviais suas propriedades químicas e físicas. Entretanto, ela possui
muitas propriedades não usuais e essenciais à vida na Terra. Uma
das propriedades mais importantes da água é a sua capacidade de
dissolver uma grande variedade de substâncias. Por essa razão, a
água é encontrada na natureza com um vasto número de substâncias
nela dissolvidas. Como exemplo dessas substâncias, podem-se citar
materiais radioativos, matérias orgânicas, coloides e metais
pesados, entre outros.
Tendo o texto acima como referência inicial, julgue os itens a
seguir, a respeito de aspectos diversos de química.
Detergentes vendidos comercialmente (sólidos ou líquidos) são misturas complexas formadas por um grande número de compostos químicos. Qualquer discussão acerca dos efeitos poluentes ou ecológicos dos detergentes, inevitavelmente, diz respeito a um ou mais dos seus componentes e dos seus comportamentos químicos em meio aquoso.
F.R. Benn e C.A. Mc Auliffe. Química e poluição. São Paulo: Ed. da USP, 1981, p.113 (com adaptações).
Considerando essas informações, assinale a alternativa correta.
Muitos aquíferos apresentam capacidade tamponante. Em alguns deles, essa característica se deve ao equilíbrio do HCO3- e do CO3- . Caso esse equilíbrio esteja presente, em uma situação tal que [CO3- ]=0,048 mol/L e [HCO3- ]=0,80 mol/L, e sabendo que pKa2 do H2CO3 é igual a 10,25, assinale a opção que apresenta a faixa de valores em que se encontra o pH dessa solução-tampão, sabendo que log0,06 = -1,25.
É bastante comum as águas naturais serem soluções mistas, muitas vezes com capacidades tamponantes. Com relação a soluções mistas e tampões, julgue os itens abaixo como Verdadeiros (V) ou Falsos (F) e, em seguida, assinale a opção correta.
I – A adição de íons acetato em uma solução de ácido acético provocará um aumento do pH da solução.
II – A capacidade tamponante diz respeito aos diversos valores de pH a que um tampão pode ser ajustado.
III – Se o pKa de uma reação de equilíbrio entre um ácido e sua base conjugada é igual a 4,8, então um tampão formado pelo equilíbrio desse ácido com sua base conjugada poderá ser ajustado somente para valores de pH maiores que 4,8.
A sequência correta é:
As águas de rios e lagos contêm quantidades significativas de dióxido de carbono. Nessa situação, o seguinte equilíbrio se estabelece: CO2(g) + H2O(l) ⇌ H2CO3(aq). Considerando esse equilíbrio, julgue os itens abaixo como Verdadeiros (V) ou Falsos (F) e, em seguida, assinale a opção correta.
I – A dissolução do CO2 na água diminui o pH da água.
II – O H2CO3 é um ácido fraco, pois na primeira dissociação libera H+, por meio da reação: H2CO3 ⇀ H+ + HCO3- , mas na segunda dissociação, que não é completa, libera OH- , conforme a reação: HCO3- ⇀ CO2 + OH- , o que reduz a quantidade de H+ disponível na solução.
III – O HCO3- é a base conjugada do H2CO3 e é considerada uma base forte.
IV – A dissolução de um ácido na água aumenta a condutividade da água.
A sequência correta é:
Os diversos componentes presentes na água, que alteram seu grau de pureza, podem ser retratados em termos de suas características físicas, químicas e biológicas. Essas características podem ser traduzidas na forma de parâmetros de qualidade da água. Acerca desse assunto, julgue o item seguinte.
O pH das águas naturais depende da presença de substâncias
dissolvidas que possuam propriedades ácido-básicas, e o seu
valor sofre influência da dissolução de rochas, da absorção de
gases da atmosfera, da oxidação da matéria orgânica e da
fotossíntese.
Durante uma aula de experimentação no laboratório da escola, um professor solicitou aos alunos que preparassem soluções utilizando um alvejante comercial e vinagre. De cada solução preparada, foram separadas duas amostras em diferentes tubos de ensaio e adicionadas gotas de indicadores, conforme a tabela a seguir.
Tubo de Ensaio
I - Alvejante
II - Vinagre
III - Alvejante
IV - Vinagre
Indicador adicionado
Extrato de repolho roxo
Extrato de repolho roxo
Verde de bromocresol
Verde de bromocresol
As cores observadas após a adição dos indicadores no tubos
de ensaio I, II, III e IV são, respectivamente,