Questões de Concurso
Sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 612 questões
Considere as situações I e II a seguir. I.
A figura abaixo representa a curva de titulação obtida pela titulação de 50 mL de uma solução de um ácido fraco monoprótico com NaOH 0,1 mol/L, bem como a primeira derivada dessa curva.

II. Na titulação de 20 mL de uma solução de Fe2+, foram
gastos 5 mL de uma solução de dicromato 0,01 mol/L para
que houvesse mudança de cor do indicador. Nesse caso,
o Fe2+ foi completamente oxidado a Fe3+ e o Cr2O7
2- foi
reduzido a Cr3+.
O ácido titulado na situação I é mais forte que o ácido propiônico, que tem pKa = 4,9.
O pH de uma solução obtida pela mistura de 50 mL de NaOH 0,1 mol/L e 50 mL de HCl 0,25 mol/L é inferior a 2.
Ao final, ele obteve um suco com concentração hidrogeniônica de
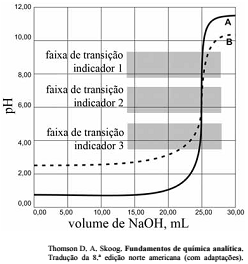
As titulações são amplamente utilizadas em química para identificar os ácidos, as bases, os oxidantes, os redutores, os íons metálicos e as proteínas. Com base nessas informações e na figura acima que apresenta um gráfico de titulação de NaOH, pH em função do volume em mL, julgue o item a seguir.
Qualquer um dos três indicadores ácido base mostrados na
figura podem ser usados para titulação de soluções mais
diluídas.
Quando um sal se dissolve em água, a solução pode ser ácida, básica ou neutra, dependendo da natureza do sal. Sabendo disso, é correto afirmar que a hidrólise do acetato de amônio (NH4C2H3O2) em água resulta em uma solução:
(Dado: Ka do ácido acético = 1,8 x 10-5 e Kb da
amônia = 1,8 x 10-5).
Uma solução tampão foi preparada a partir da mistura de uma solução 1,00 M de hidróxido de amônio (NH4OH) com uma solução 1,00 M de cloreto de amônio (NH4Cl), totalizando 1,0 litro. Em seguida foi adicionado 0,20 mol de OH- a solução tampão e o pH calculado. Sabendo que o valor de pKb é igual a 4,74, o pH da solução após a adição de 0,20 mol de OH- é igual a:
(Dado Kb:1,8 x 10-5; log de 0,66 = - 0,176)
Equação 1
2C15H14O3(s) + Na2CO3(aq) ⇔ 2C15H13O3-Na+ (aq) + CO2(aq) + H2O(ℓ)
composto amarelo-claro, insolúvel em água sal de sódio do lapachol, vermelho, solúvel em água
Equação 2
C15H13O3-Na+ (aq) + HCl(aq) ⇔ C15H14O3(S) + NaCl(aq)
Através da análise das equações 1 e 2 acima é INCORRETO afirmar:
O professor está programando a sua aula de titulação e precisa escolher qual o indicador ácido-base que usará para indicar o final da titulação entre solução aquosa de ácido clorídrico (titulante) e hidróxido de potássio. Dentre as opções que ele dispõe e que estão listadas abaixo, qual a melhor para esta titulação?
Indicador Zona de viragem
Violeta de metila (amarelo) 0,0 – 1,6 (azul-púrpura)
Azul de bromotimol (amarelo) 3,0 – 4,6 (violeta)
Alaranjado de metila (vermelho) 3,4 – 4,4 (amarelo)
Fenolftaleína (incolor) 8,2 – 10,0 (rosa)
Carmin de indigo (azul) 11,4 – 13,0 (amarelo)
Indique, dentre os ácidos listados abaixo, aquele cuja base conjugada será a mais forte:
ácido Ka
Acético 1,75 x 10-5
Bórico 6,4 x 10-10
Benzoico 6,3 x 10-5
Lático 1,4 x 10-4
Oxálico 6,5 x 10-2
Dado: pKa do ácido acético = 4,74
