Questões de Concurso
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 2.135 questões
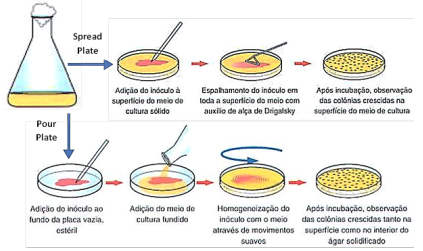
Considerando o que mostra a figura e sobre o uso desses métodos na contagem bacteriana, assinale a afirmativa incorreta.
I. O teste do NMP típico é realizado em três baterias de cinco tubos, cada uma correspondendo a um volume de 10, 1 e 0,1 mL de uma dada diluição. Os tubos que contêm microrganismos mostrarão crescimento pela produção de bolhas de gás e/ou se tornarão turvos quando incubados. O número de organismos na cultura original, então, será estimado a partir de uma tabela de números mais prováveis, que especifica que o número de organismos na cultura original possui 95% de chances de estarem dentro de uma faixa específica. Assim, quanto mais tubos mostram crescimento, em especial, aqueles com diluições maiores, mais organismos se estão presentes na amostra.
II. O método do NMP é utilizado quando as amostras contêm muitos organismos que promovam contagens confiáveis do tamanho da população através do método de contagem padrão, ou quando os organismos crescem bem em ágar. Com esse método, a partir da observação da amostra, se calcula o número de células e se realiza uma série de diluições maiores que, à medida que o fator de diluição aumenta, será obtido um ponto no qual tubos irão conter um único organismo, enquanto outros nenhum.
III. O método do NMP pode ser usado para estimar o número de células viáveis na população. Esse método é baseado na distribuição estatística dos organismos na suspensão. Quando amostras com volumes fixos são tomadas de uma suspensão celular, algumas podem ter mais células do que outras. Amostras repetidas da suspensão, contudo, produzem um número médio de organismos, definido como número mais provável.
Assinale
I. Nanocatalisadores são catalisadores feitos átomo por átomo e são produzidos de maneira controlada através de diferentes métodos de preparação que tem como resultado final as mudanças nas propriedades catalíticas das nanopartículas.
II. A maior dificuldade de aplicação se deve ao seu tamanho reduzido, o que corrobora a alta tendência de aglomeração, consequência das forças de Van der Waals.
III. As nanopartículas de metal geralmente são depositadas ou sintetizadas em um suporte adequado.
Assinale
Tendo como referência as informações precedentes, julgue o item subsecutivo, a respeito de fundamentos de estatística.
Se a determinação cromatográfica de isoctano em uma
mistura de hidrocarbonetos revelou a presença de 3,1943%
de isoctano, com desvio padrão de 0,0327%, então o
laudo de análise deve apresentar o resultado da seguinte
forma: (3,1943 ± 0,0327)%.
Acerca de eletrodos de membrana de vidro, titulação potenciométrica e medida de condutividade, julgue o item subsequente.
Titulação potenciométrica é um método analítico utilizado
para determinar a concentração de uma substância em uma
solução com base na medição do potencial elétrico gerado
durante uma reação química.
Acerca de eletrodos de membrana de vidro, titulação potenciométrica e medida de condutividade, julgue o item subsequente.
A condutividade elétrica é uma propriedade que depende da
presença de íons dissolvidos em soluções iônicas, como
ácidos, bases e sais, pois os íons permitem a passagem da
corrente elétrica. A medida da condutividade é afetada pela
temperatura, geralmente decrescendo com o aumento da
temperatura.
A partir das informações do texto precedente, julgue o próximo item.
A água salgada residual presente no petróleo contendo sais
minerais dissolvidos possui ponto de ebulição menor que o
da água destilada à mesma pressão.
A partir das informações do texto precedente, julgue o próximo item.
A titulação de Karl Fischer é um método analítico bastante
utilizado para a determinação da viscosidade em amostras de
derivados de petróleo.
Acerca de reações inorgânicas, julgue o item que se segue.
A reação 2 NaCl + I2 → 2 NaI + Cl2 ocorre espontaneamente.
Acerca de reações inorgânicas, julgue o item que se segue.
A reação 2 NaN3 → 2 Na + 3 N2 representa um processo de
síntese.
Acerca de reações inorgânicas, julgue o item que se segue.
A reação Ca(NO3)2 + Na2CO3 → CaCO3 + 2 NaNO3 é do
tipo dupla troca.
Com base nessa reação química, julgue o próximo item.
O Ca(HCO3)2 é o carbonato de cálcio.
Com base nessa reação química, julgue o próximo item.
Participam da reação três óxidos e dois sais.
Acerca de funções químicas, julgue o item a seguir.
Bases são caracterizadas pela liberação de íons OH−
e serão
tão mais fortes quanto mais estáveis forem suas fases não
ionizadas.
Acerca de funções químicas, julgue o item a seguir.
Os ácidos fortes são aqueles que se ionizam completamente
em solução aquosa, liberando todos os seus íons H+
, tendo
alta capacidade de doar prótons (íons H+
).
Acerca de funções químicas, julgue o item a seguir.
O potencial de neutralização de um ácido forte é maior em
um ácido fraco que em uma base forte.
Um estudante, em laboratório, e utilizando corretamente equipamentos de proteção individual, organizou todos os reagentes e vidrarias necessários para realizar uma titulação. Em um Erlenmeyer, ele adicionou 25 mL de uma solução de ácido oxálico, H2C2O4, que possui dois hidrogênios ionizáveis. Na bureta, o titulante por ele utilizado foi o NaOH(aq) com concentração 0,1 mol.L-1. Ao realizar, cuidadosamente, a titulação, o ponto estequiométrico foi atingido após a adição de 38 mL da solução básica. Portanto, a concentração em mol.L-1 do ácido oxálico é:
Algumas substâncias em soluções podem modificar o ponto de ebulição ou de congelamento em relação ao solvente puro. “A redução do ponto de congelamento e o aumento do ponto de ebulição são propriedades físicas das soluções que dependem da quantidade (concentração), mas não do tipo ou identidade das partículas do soluto. Tais propriedades são chamadas propriedades coligativas”. Considerando o ponto de congelamento do etanol igual a -114,6 °C e, para essa temperatura, a constante crioscópica (Kc) 1,99 °C.mol. kg-1, o ponto de congelamento de uma solução contendo 0,5 kg de C2H5OH e 77 g de eucaliptol (C10H18O), uma substância encontrada na folha do eucalipto, será:
(BROWN; LEMAY; BURSTEN, Química: a ciência central, São Paulo: Pearson Prentice Hall, 2005)