Questões de Concurso Público PETROQUÍMICA SUAPE 2011 para Técnico de Laboratório Júnior
Foram encontradas 50 questões
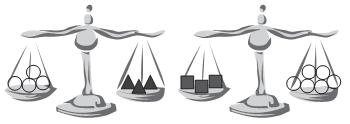
As duas balanças acima estão equilibradas. Os objetos de mesmo formato têm pesos iguais.
Em relação aos pesos, conclui-se que
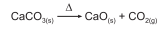
A quantidade máxima, em kg, de óxido de cálcio que se obtém a partir de 200 kg de calcário, contendo 90% em massa de carbonato de cálcio, é


Se, no frasco Erlenmeyer, há 25,00 mL de HCL(aq) 0,200 mol/L, o volume de NaOH(aq) 0,100 mol/L que deve escoar da bureta, em mL, até se atingir o ponto estequiométrico, é
No meio aquoso, esses dois sais reagem instantaneamente, de acordo com a equação balanceada abaixo, e nela se forma um sal muito pouco solúvel.

A quantidade máxima, em gramas, de AgCL sólido (massa molar = 143,5 g/mol e Kps = 10-10 ) que se forma é de, aproximadamente,
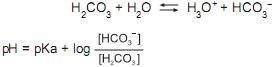
Sobre o equilíbrio de um sistema contendo 100 mL de solução 0,1 mol/L de H 2CO3 e 0,1 mol/L de HCO3– , quando se adiciona(m)
E° Ag+1 /Ago = + 0,80 V
E° Cu+2 /Cuo = + 0,34 V
Sobre a pilha, conclui-se que ela funciona de maneira espontânea e que
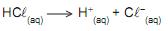
O volume, em mL, de solução aquosa de HCL0,1 mol/L necessário para o preparo de 1 L de solução com pH = 3 é
Na etapa anterior ao forte aquecimento, pesou-se um sulfa- to ferroso hidratado (amostra), e a massa medida foi igual a 2,010 g. Após forte aquecimento em mufla, pesou-se o sulfato ferroso, sem a água de hidratação, e a massa medida foi igual a 1,095 g. De posse desses dados obtidos, conclui-se que o sal hidratado tem fórmula

