Questões de Concurso Público POLITEC-RO 2022 para Perito Criminal - Área 8 - Química
Foram encontradas 100 questões
Nessa situação hipotética, ante a possibilidade de morte por asfixia por monóxido de carbono, o perito, durante o exame perinecroscópico, deverá dedicar especial atenção aos livores de hipóstase, que, em casos tais, terão a tonalidade
Nessa situação hipotética, considerando a conceituação e a divisão doutrinária de local de crime, o perito deverá
Nessa situação hipotética, os papéis manuseados pelos autores do crime


I A pressão parcial do CO (g), a qualquer momento, será igual à pressão parcial do CH4 (g).
II A pressão total, a qualquer momento, corresponde à média entre as pressões parciais de cada gás presente no sistema.
III A pressão parcial do H2 (g) será sempre superior à do CO (g).
Assinale a opção correta.

Nessa situação, o comportamento descrito deve-se
O SO2Cl2 (g) decompõe-se facilmente de acordo com aequação:
SO2Cl2 (g) ⇌ SO2 (g) + Cl2 (g) ΔH > 0
Por esse motivo, ele é muito empregado como fonte deCl2 (g) em reações químicas.
Considere que todas as espécies gasosas envolvidas nessa
reação apresentem comportamento ideal e que a lei de velocidade
para a reação seja dada pela equação v = k × [SO2Cl2]. Considere
também que, na temperatura em que a reação ocorre (T), a
constante de equilíbrio (Keq) da reação valha 0,40.
O SO2Cl2 (g) decompõe-se facilmente de acordo com aequação:
SO2Cl2 (g) ⇌ SO2 (g) + Cl2 (g) ΔH > 0
Por esse motivo, ele é muito empregado como fonte deCl2 (g) em reações químicas.
Considere que todas as espécies gasosas envolvidas nessa
reação apresentem comportamento ideal e que a lei de velocidade
para a reação seja dada pela equação v = k × [SO2Cl2]. Considere
também que, na temperatura em que a reação ocorre (T), a
constante de equilíbrio (Keq) da reação valha 0,40.
O SO2Cl2 (g) decompõe-se facilmente de acordo com aequação:
SO2Cl2 (g) ⇌ SO2 (g) + Cl2 (g) ΔH > 0
Por esse motivo, ele é muito empregado como fonte deCl2 (g) em reações químicas.
Considere que todas as espécies gasosas envolvidas nessa
reação apresentem comportamento ideal e que a lei de velocidade
para a reação seja dada pela equação v = k × [SO2Cl2]. Considere
também que, na temperatura em que a reação ocorre (T), a
constante de equilíbrio (Keq) da reação valha 0,40.
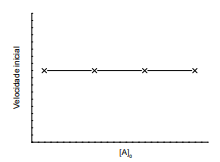
Figura 1. Gráfico da velocidade inicial em função da concentração inicial de A
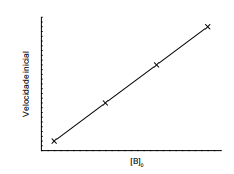
Figura 2. Gráfico da velocidade inicial em função da concentração inicial de B
Com base no procedimento descrito, infere-se que a reação em tela é de ordem