Questões de Concurso Público UFTM 2016 para Tecnólogo - Química
Foram encontradas 20 questões
Solventes polares apróticos são solventes que apresentam altas constantes dielétricas e são amplamente empregados em síntese orgânica. A estrutura dos solventes polares apróticos está relacionada à sua constante dielétrica. Considere os seguintes solventes:
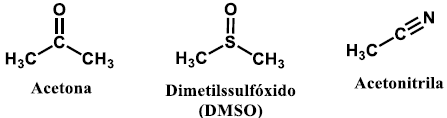
A ordem crescente de constante dielétrica dos solventes apresentados é:
A constante de equilíbrio KC para a seguinte reação é 0,80 a uma dada temperatura. Um recipiente de 5,00L contém 0,4 mol de FeBr3, 0,5 mol de FeBr2 e 0,4 mol de Br2 nessa temperatura.
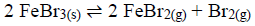
Com base no exposto, assinale a alternativa CORRETA.
O processo Haber-Bosch é utilizado industrialmente para a produção de amônia. A quantidade de NH3 produzida na reação entre N2 e H2 é influenciada, entre outros fatores, por pressão e temperatura. A produção da amônia pode ser representada pela equação química a seguir:

O gráfico 1 representa a variação de porcentagem de amônia produzida em reações realizadas a diferentes temperaturas, à pressão de 500 atm.
O quadro 1 apresenta quatro diferentes condições de reação testadas, variando-se a temperatura e as quantidades dos gases reagentes. Considere que o gás apresentado no quadro seja o reagente limitante na condição em questão.

Abaixo estão várias configurações eletrônicas que podem estar corretas para o átomo de nitrogênio (Z = 7). Os elétrons são representados por setas cuja direção indica o valor do número quântico spin, ms. Os três círculos para os orbitais p indicam os possíveis valores para o número quântico magnético, ml. Os estados podem ser classificados como fundamental se a configuração eletrônica representa o estado fundamental do átomo de nitrogênio, excitado se a configuração representa um possível estado excitado, ou proibido, se a configuração não pode existir.
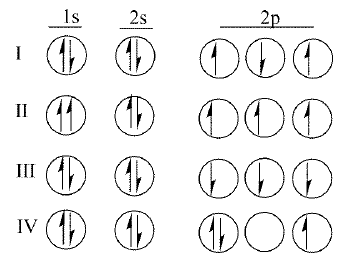
A classificação dos estados representados nas configurações de I a IV, nesta ordem, é:
Considere as reações I e II a seguir:
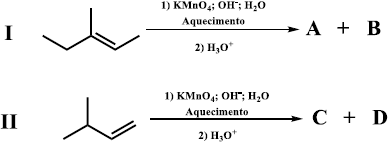
Os produtos A, B, C, D são respectivamente:

Em uma blitz policial, o carro de um motorista foi revistado, encontrando-se um sólido branco suspeito que apresentou resultado positivo para alcaloide. Se a substância encontrada for a codeína, o motorista será liberado, se for a morfina, o motorista precisa apresentar receita médica que justifique o porte de tal substância, e se for a heroína, o motorista será preso.
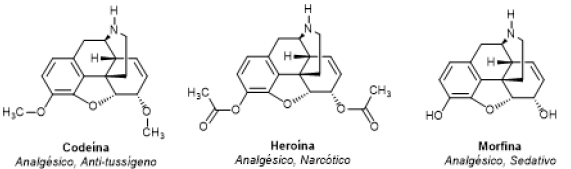
Seria possível inferir se o motorista cometeu alguma infração ou irregularidade utilizando uma análise
de infravermelho?
A Teoria do Orbital Molecular (TOM) permite prever a existência de espécies, como íons moleculares,sua estabilidade relativa e algumas propriedades. Entretanto a TOM não prevê a existência da espécie He2. Porém essa espécie existe apenas à temperatura de 4,5 K, possuindo comprimento de ligação de 52 angstrons e energia de ligação de 9,63x10-3J mol-1 determinados experimentalmente. Com base na TOM,avalie as afirmações a seguir.
Dado He (Z = 2)
I. A espécie He2 possui ordem de ligação igual a zero e é estável.
II. Ordem de ligação no íon molecular He2+é menor que no dímero de hélio
III. O comprimento de ligação do He2+é menor que do He2.
IV. As energias dos orbitais moleculares 1σg e 1σu do He2+e H2+ são as mesmas.
Assinale a alternativa que apresenta somente as afirmações CORRETAS:
Um copo, com capacidade de 250 mL, contém 100 mL de uma solução aquosa 0,10 mol L-1 de ácido acético na temperatura de 25°C. Após a adição de mais 100 mL de água pura a essa solução, com a temperatura permanecendo constante, as consequências sobre a concentração de íons acetato (mol L-1) e quantidade de íons acetato (mol), respectivamente são:
Dados: Ka = 1,8.10-5, √1,8x10-6 = 0,0013 e √9x10-7
= 0,0095.
Defensivos agrícolas são intensamente usados na proteção das plantações. A concentração do produto aplicado prescrita por agrônomos depende da pureza do produto. O Captan (C9H8O2Cl3NS) é um fungicida especialmente eficiente contra a praga de ferrugem. Na sua forma pura é uma substância cristalina branca, com ponto de fusão de 175°C, pouco solúvel em água. Um produto de grau técnico, de cor acinzentada, com ponto de fusão de 164°C, foi levado a um laboratório químico para análise. Uma amostra de 0,5500 g foi pesada e corretamente manipulada para se proceder a hidrólise e subsequente liberação dos íons cloreto e da tetrahidroftalimida (C8H9NO2). A seguir foi cuidadosamente tratada com 50,00 mL de uma solução padrão de AgNO3 0,1000 mol L-1. O excesso destes íons Ag+ foi titulado com outra solução padrão de KSCN 0,0500 mol L -1, gastando-se 10,00 mL até atingir o ponto final da titulação, utilizando como indicador uma pequena quantidade de íons Fe3+.
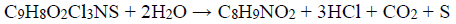
Dados: C9H8O2Cl3NS; 300,5 g mol-1 , C8H9NO2;151 g mol-1
Com base nas informações fornecidas pelo problema é CORRETO afirmar:
O íon potássio em 250,0 mL de uma amostra de água mineral foi precipitado com tetrafenilborato de sódio:
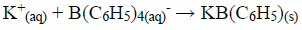
O precipitado foi filtrado, lavado e redissolvido em um solvente orgânico. Um excesso de quelato EDTA/mercúrio(II) foi adicionado:
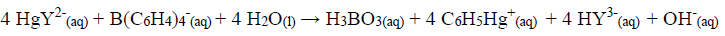
O EDTA liberado foi titulado com 30,00 mL de Mg2+ 0,0550 mol L-1.
(Dado: K = 39 g mol-1, Mg = 24 g mol-1)
Após a análise, a concentração aproximada do íon potássio em partes por milhão será:
A obtenção de compostos que apresentam atividade farmacológica a partir de plantas é uma área da química que desperta grande atenção no Brasil. A obtenção desses compostos envolve diversas operações de laboratório. Nesse sentido, numere a segunda coluna de acordo com a primeira, relacionando as operações de laboratório com os respectivos equipamentos utilizados.
1. trituração
2. filtração a vácuo
3. extração com solvente
4. eliminação do solvente a pressão reduzida
5. separação da substância de interesse
( ) funil de Büchner
( ) coluna cromatográfica
( ) evaporador rotatório
( ) almofariz e pistilo
( ) funil de extração
A sequência numérica CORRETA, de cima para baixo, é:
