Questões de Concurso
Foram encontradas 9.182 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
J. M. Riveros (editorial). O legado de Niels Bohr. In: Química Nova, v. 36, n.° 7, 2013, p. 931-932 (com adaptações).
Quanto ao postulado para o átomo de hidrogênio apresentado pelo modelo teórico para a estrutura eletrônica de átomos proposto por Bohr, que se baseia no modelo planetário introduzido por Rutherford, assinale a alternativa correta.
Considerando-se a seguinte reação, que envolve íons do
átomo de cobre 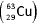 : Cu2+ (aq) + e- → Cu+ (aq), assinale a
alternativa que apresenta, correta e respectivamente, o
número de prótons, elétrons e nêutrons da espécie iônica de
cobre produto dessa reação.
: Cu2+ (aq) + e- → Cu+ (aq), assinale a
alternativa que apresenta, correta e respectivamente, o
número de prótons, elétrons e nêutrons da espécie iônica de
cobre produto dessa reação.
Texto para a questão.
Curvas de solubilidade em água em função da temperatura para algumas substâncias

Texto para a questão.
Curvas de solubilidade em água em função da temperatura para algumas substâncias

Deseja-se preparar duas soluções saturadas na temperatura de 20 °C, uma contendo o sal menos solúvel e outra contendo o sal mais solúvel nessa temperatura. Para cada uma das soluções, será empregado o mínimo possível dos sais e será utilizado 1 L de água, mantida a 20 °C durante todo o processo de dissolução. A massa específica da água é igual a 1.000 kg m-3.
Com base nesse caso hipotético e no gráfico, assinale a alternativa que apresenta, correta e respectivamente, as massas aproximadas dos dois sais necessárias para o preparo dessas soluções.
Texto para a questão.
Curvas de solubilidade em água em função da temperatura para algumas substâncias

Texto para a questão.
A solubilidade é um dos temas mais relevantes da área da química, tanto por sua importância intrínseca quanto pela variedade de fenômenos e propriedades químicas envolvidas em seu entendimento. O processo de solubilização de uma substância resulta da interação entre a espécie que se deseja solubilizar (soluto) e a substância que a dissolve (solvente) e pode ser definida como a quantidade de soluto que dissolve, em uma determinada quantidade de solvente, em condições de equilíbrio. Solubilidade é, portanto, um termo quantitativo.
C. R. Martins, W. A. Lopes e J. B. Andrade. Solubilidade das
substâncias orgânicas. In: Química Nova, v. 36, n.° 8,
2013, p. 1.248-1.255 (com adaptações).
Texto para a questão.
A solubilidade é um dos temas mais relevantes da área da química, tanto por sua importância intrínseca quanto pela variedade de fenômenos e propriedades químicas envolvidas em seu entendimento. O processo de solubilização de uma substância resulta da interação entre a espécie que se deseja solubilizar (soluto) e a substância que a dissolve (solvente) e pode ser definida como a quantidade de soluto que dissolve, em uma determinada quantidade de solvente, em condições de equilíbrio. Solubilidade é, portanto, um termo quantitativo.
C. R. Martins, W. A. Lopes e J. B. Andrade. Solubilidade das
substâncias orgânicas. In: Química Nova, v. 36, n.° 8,
2013, p. 1.248-1.255 (com adaptações).
Texto para a questão.
A solubilidade é um dos temas mais relevantes da área da química, tanto por sua importância intrínseca quanto pela variedade de fenômenos e propriedades químicas envolvidas em seu entendimento. O processo de solubilização de uma substância resulta da interação entre a espécie que se deseja solubilizar (soluto) e a substância que a dissolve (solvente) e pode ser definida como a quantidade de soluto que dissolve, em uma determinada quantidade de solvente, em condições de equilíbrio. Solubilidade é, portanto, um termo quantitativo.
C. R. Martins, W. A. Lopes e J. B. Andrade. Solubilidade das
substâncias orgânicas. In: Química Nova, v. 36, n.° 8,
2013, p. 1.248-1.255 (com adaptações).
SKOOG, D. A.; KOLLER, F. J.; NIEMAN, T. A. Princípios da Análise Instrumental. 5ª ed. Porto Alegre: Bookman, 2002.
Com relação aos princípios da técnica de cromatografia iônica, assinale V para a afirmativa verdadeira e F para a falsa.
( ) Íons monovalentes ficam retidos na coluna de troca iônica mais fortemente que íons polivalentes. ( ) Resinas trocadoras de cátions comuns exibem sítios ativos que contém grupos ácidos sulfônicos ou carboxílicos. ( ) A ordem de eluição em colunas trocadoras de ânions esperada para os haletos é F- , Cl- , Br- , I- .
Segundo a ordem apresentada, as afirmativas são, respectivamente,
1) H2S (aq) + 4 Cl2 (aq) + 4 H2O (liq)
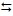 8 HCl (aq) + H2SO4 (aq)
2) 2 Fe(HCO3)2 (aq) + Cl2 (aq) + Ca(HCO3)2 (aq)
8 HCl (aq) + H2SO4 (aq)
2) 2 Fe(HCO3)2 (aq) + Cl2 (aq) + Ca(HCO3)2 (aq) 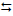 2 Fe(OH)3 (s) + CaCl2
(aq) + 6 CO2 (g)
3) MnSO4 (aq) + Cl2 (aq) + 4 NaOH (aq)
2 Fe(OH)3 (s) + CaCl2
(aq) + 6 CO2 (g)
3) MnSO4 (aq) + Cl2 (aq) + 4 NaOH (aq) 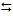 MnO2 (ppt) + 2 NaCl (aq) +
Na2SO4 (aq) + 2H2O (liq)
MnO2 (ppt) + 2 NaCl (aq) +
Na2SO4 (aq) + 2H2O (liq)
Analise as afirmativas a seguir, relacionadas com as reações.
I. Na reação 1, o enxofre sofre oxidação e o cloro é o agente redutor. II. Na reação 2, o ferro sofre oxidação e o cloro sofre redução. III. Na reação 3, o manganês sofre redução e o cloro é o agente oxidante.
Está correto o que se afirma em
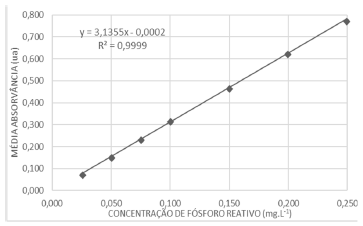
Nas mesmas condições analíticas uma amostra de água doce de um reservatório classe 2 com concentração desconhecida apresentou absorvância média 0,142 ua.
A concentração de fósforo reativo (em mg.L-1) na amostra é, aproximadamente, de
A alcalinidade total da amostra, em mgCaCO3.L-1, corresponde aproximadamente a
Dados: massas molares em g.mol-1: C = 12; O = 16; Ca = 40. Equação para a titulação: 2HCl + CaCO3 → CaCl2 + H2O + CO2.
Se a quantidade de matéria orgânica e de microrganismos aeróbios no esgoto for alta, a diminuição da concentração de oxigênio dissolvido no meio provocará alterações no ambiente aquático.
A quantidade de oxigênio necessária para o consumo da matéria orgânica pode ser avaliada em laboratório, utilizando o excesso do reagente
O volume previsto de titulado que deverá ser gasto nesse processo, considerando nenhum tipo de perda será de
Dados: massas molares (g.mol-1) C= 12; O=16; Na= 23.
A adição de NH3(aq) a uma solução saturada de cloreto de prata em contato com o precipitado resultará
2SO3(g)
 2SO2(g) + O2(g).
2SO2(g) + O2(g).
Inicialmente a pressão parcial do trióxido de enxofre era de 1,6 bar. Ao atingir o equilíbrio foi constatada uma porcentagem de decomposição de 60%.
Se a esse sistema em equilíbrio for adicionado 1 mmol de dióxido de enxofre, mantendo-se constante as condições anteriores, quando o novo equilíbrio for atingido,