Questões de Concurso
Para professor - química
Foram encontradas 4.410 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Um químico desejava preparar 500 mL de uma solução de hidróxido de amônio (NH4OH) 0,10 mol/L pela diluição de uma solução estoque de NH4OH que, segundo o rótulo do frasco, apresenta concentração 30% em m assa e densidade 0,895 g/mL. Com base nesses dados, o químico realizou o cálculo do volume da solução estoque a ser em pregado e preparou a solução. Como a amônia é um a substância altamente volátil, o químico julgou conveniente aferir a concentração da solução resultante realizando a titulação de 20,0 mL dessa solução com uma solução padrão de HC1 0,090 mol/L.
Considerando que, a 25 °C, a constante de basicidade do NH4OH é igual a 1,8 x 10 -5 e a constante de autoprotólise da água, definida como o produto das atividades dos íons hidróxido e hidrônio, é igual a 1,0 x 10-14 , e atribuindo comportamento ideal para todas as soluções envolvidas, julgue o item seguinte, tendo o texto apresentado como referência.
A 25 °C, a porcentagem de dissociação do NH4OH em uma
solução 0,10 mol/L é superior a 1 %.
Um químico desejava preparar 500 mL de uma solução de hidróxido de amônio (NH4OH) 0,10 mol/L pela diluição de uma solução estoque de NH4OH que, segundo o rótulo do frasco, apresenta concentração 30% em m assa e densidade 0,895 g/mL. Com base nesses dados, o químico realizou o cálculo do volume da solução estoque a ser em pregado e preparou a solução. Como a amônia é um a substância altamente volátil, o químico julgou conveniente aferir a concentração da solução resultante realizando a titulação de 20,0 mL dessa solução com uma solução padrão de HC1 0,090 mol/L.
Considerando que, a 25 °C, a constante de basicidade do NH4OH é igual a 1,8 x 10 5 e a constante de autoprotólise da água, definida como o produto das atividades dos íons hidróxido e hidrônio, é igual a 1,0 x 10-14 , e atribuindo comportamento ideal para todas as soluções envolvidas, julgue o item seguinte, tendo o texto apresentado como referência.
O indicador ácido-base mais apropriado para a detecção do
ponto final da titulação deve apresentar a faixa de viragem em
pH ácido.
Um químico desejava preparar 500 mL de uma solução de hidróxido de amônio (NH4OH) 0,10 mol/L pela diluição de uma solução estoque de NH4OH que, segundo o rótulo do frasco, apresenta concentração 30% em m assa e densidade 0,895 g/mL. Com base nesses dados, o químico realizou o cálculo do volume da solução estoque a ser em pregado e preparou a solução. Como a amônia é um a substância altamente volátil, o químico julgou conveniente aferir a concentração da solução resultante realizando a titulação de 20,0 mL dessa solução com uma solução padrão de HC1 0,090 mol/L.
Considerando que, a 25 °C, a constante de basicidade do NH4OH é igual a 1,8 x 10 5 e a constante de autoprotólise da água, definida como o produto das atividades dos íons hidróxido e hidrônio, é igual a 1,0 x 10-14 , e atribuindo comportamento ideal para todas as soluções envolvidas, julgue o item seguinte, tendo o texto apresentado como referência.
O volume de solução estoque em pregada para a preparação da
solução desejada foi superior a 8,0 mL.
Um químico desejava preparar 500 mL de uma solução de hidróxido de amônio (NH4OH) 0,10 mol/L pela diluição de uma solução estoque de NH4OH que, segundo o rótulo do frasco, apresenta concentração 30% em m assa e densidade 0,895 g/mL. Com base nesses dados, o químico realizou o cálculo do volume da solução estoque a ser em pregado e preparou a solução. Como a amônia é um a substância altamente volátil, o químico julgou conveniente aferir a concentração da solução resultante realizando a titulação de 20,0 mL dessa solução com uma solução padrão de HC1 0,090 mol/L.
Considerando que, a 25 °C, a constante de basicidade do NH4OH é igual a 1,8 x 10 5 e a constante de autoprotólise da água, definida como o produto das atividades dos íons hidróxido e hidrônio, é igual a 1,0 x 10-14 , e atribuindo comportamento ideal para todas as soluções envolvidas, julgue o item seguinte, tendo o texto apresentado como referência.
De acordo com os dados fornecidos no rótulo do frasco, a
concentração da solução estoque de NH4OH é superior a 7,0
mol/L.
O bombardeamento do urânio-235 com nêutrons induz a um a série de reações de fissão nuclear altamente energéticas. Em uma dessas reações, após a captura de um nêutron (1n), o urânio se desintegra para formar um átomo de césio-137, um isótopo X, e dois outros nêutrons capazes de gerar uma reação em cadeia:
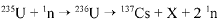
O césio-137 assim formado é um isótopo radioativo que emite radiações gama e beta e pode ser em pregado em radioterapia com o intuito de destruir células cancerosas.
A partir do texto acima e considerando que o tempo de m eia-vida do césio-137 é de 30 anos, julgue o item que se segue.
Mesmo após um período de 300 anos, mais de 1% dos átomos
de césio-137 deverão estar ativos.
O bombardeamento do urânio-235 com nêutrons induz a um a série de reações de fissão nuclear altamente energéticas. Em uma dessas reações, após a captura de um nêutron (1n), o urânio se desintegra para formar um átomo de césio-137, um isótopo X, e dois outros nêutrons capazes de gerar uma reação em cadeia:
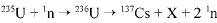
O césio-137 assim formado é um isótopo radioativo que emite radiações gama e beta e pode ser em pregado em radioterapia com o intuito de destruir células cancerosas.
A partir do texto acima e considerando que o tempo de m eia-vida do césio-137 é de 30 anos, julgue o item que se segue.
A radiação beta possui maior poder de penetração que a
radiação gama.
O bombardeamento do urânio-235 com nêutrons induz a um a série de reações de fissão nuclear altamente energéticas. Em uma dessas reações, após a captura de um nêutron (1n), o urânio se desintegra para formar um átomo de césio-137, um isótopo X, e dois outros nêutrons capazes de gerar uma reação em cadeia:
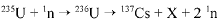
O césio-137 assim formado é um isótopo radioativo que emite radiações gama e beta e pode ser em pregado em radioterapia com o intuito de destruir células cancerosas.
A partir do texto acima e considerando que o tempo de m eia-vida do césio-137 é de 30 anos, julgue o item que se segue.
O isótopo X da reação apresentada consiste em um átomo de 98Sr.
A LDB recomenda que o professor escolha, logo no início do ano, o tipo de avaliação que utilizará ao final do conteúdo ministrado, pois, assim, garantirá a segurança dos resultados alcançados.
A LDB prevê a avaliação do aluno pelo professor, assim como a avaliação do sistema educacional.
Provas orais ou escritas, questionários e redações são instrumentos da avaliação formal. Os juízos de valor emitidos pelo professor sobre as competências dos alunos fazem parte do plano da avaliação informal.
A avaliação deve acontecer sempre ao final do conteúdo ministrado para que o professor possa descobrir o que o aluno não aprendeu.
Defesas de projetos, dissertações e teses são instrumentos válidos de avaliação.
A atribuição de notas é preponderante na avaliação formativa.
A avaliação diagnostica é utilizada para identificar as patologias que impedem a criança de aprender na escola.
No sistema de ensino, a prática de compartimentalização do saber e da inteligência e a visão reducionista das coisas rompem com a complexidade do mundo. A cerca desse assunto, julgue o próximo item.
A educação deve favorecer a aptidão natural da mente em
formular e resolver problemas essenciais e deve estimular o uso
da inteligência geral, predominante no período da infância e
extinta na adolescência em razão do aprendizado dos princípios
reducionistas das coisas.
Segundo a teoria behaviorista, o com portamento é resultante da interação entre aquilo que o indivíduo faz e o ambiente onde o seu fazer acontece. A esse respeito, julgue o próximo item.
O uso do reforço positivo, na prática de ensino, é uma estratégia
adotada pelos professores para aumentar a probabilidade de o
aluno dar respostas de acordo com os objetivos esperados.
A assimilação é um processo cognitivo em que uma pessoa integra novo conhecimento, conceito, ideia, experiência ou dado perceptual aos esquemas ou padrões de comportamentos já existentes.
Tanto na abordagem construtivista de Piaget, quanto na sócio-interacionista de Vigotsky, a aprendizagem é considerada a força propulsora para o desenvolvimento intelectual da criança.
A gestalt considera importante como o aluno percebe os estímulos fornecidos em sala de aula, porém não considera esses dados importantes para o desenvolvimento da aprendizagem.
As teorias da aprendizagem podem ser reunidas em duas categorias: as teorias do condicionamento e as teorias cognitivistas. A respeito desse assunto, julgue o item a seguir.
Para as teorias comportamentalistas, a aprendizagem é uma
experiência que não deve ser entendida como uma resposta
a estímulos.