Questões de Vestibular
Sobre representação das transformações químicas em química
Foram encontradas 889 questões
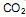 precisa ser retirado. Sabendo-se que o
precisa ser retirado. Sabendo-se que o 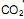 é um óxido ácido, esses trajes possuem um sistema de purificação do ar contendo basicamente hidróxido de lítio, substância que, em contato com o
é um óxido ácido, esses trajes possuem um sistema de purificação do ar contendo basicamente hidróxido de lítio, substância que, em contato com o 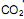 produz carbonato de lítio e água. Considerando que o traje espacial possui uma capacidade máxima de volume para expandir, além do corpo da pessoa, de 5,2 Litros, a temperatura e pressão constantes de 29ºC e 760 mmHg, respectivamente. Qual a massa de hidróxido de lítio necessário para retirar todo o
produz carbonato de lítio e água. Considerando que o traje espacial possui uma capacidade máxima de volume para expandir, além do corpo da pessoa, de 5,2 Litros, a temperatura e pressão constantes de 29ºC e 760 mmHg, respectivamente. Qual a massa de hidróxido de lítio necessário para retirar todo o 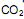 produzido quando o traje atingir seu volume máximo? (Dado: R= 0,082 atm L mol -1 K-1 )
produzido quando o traje atingir seu volume máximo? (Dado: R= 0,082 atm L mol -1 K-1 ) 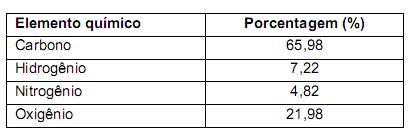
De acordo com as informações acima, os valores de x e y são, respectivamente,
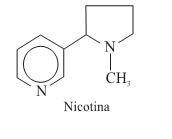
Numa embalagem de cigarros, consta que o produto contém mais de 4700 substâncias tóxicas, sendo relacionados o alcatrão, com 6 mg, o monóxido de carbono, com 8 mg, e a nicotina, com 0,65 mg. Os teores dessas substâncias referem-se à fumaça gerada pela queima de um cigarro. A quantidade em mol de moléculas de nicotina presentes na fumaça de um cigarro dessa embalagem é
Um desses feromônios é o 1-octen-3-ol, que tem esta estrutura:
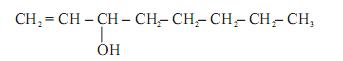
Considerando-se a estrutura desse álcool, é CORRETO afirmar que ele apresenta
As duas reações que, então, ocorrem estão representadas nestas equações:
I) CO32- (aq) + H- (aq) → HCO3- (aq) II) HCO3- (aq) + H- (aq) → H2CO3 (aq)
Para se converterem os íons carbonato e bicarbonato dessa amostra em ácido carbônico,
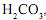 foram consumidos 20 mL da solução ácida. Pelo uso de ndicadores apropriados, é possível constatar-se que, na reação I, foram consumidos 5 mL dessa solução ácida e, na reação II, os 15 mL restantes.
foram consumidos 20 mL da solução ácida. Pelo uso de ndicadores apropriados, é possível constatar-se que, na reação I, foram consumidos 5 mL dessa solução ácida e, na reação II, os 15 mL restantes.Considerando-se essas informações, é CORRETO afirmar que, na amostra de água analisada, a proporção inicial entre a concentração de íons carbonato e a de íons bicarbonato era de
2 C6H6 (l) + 15 O2 (g) → 12 CO2 (g) + 6H2O (l) ΔH = -6,55 x 103 kJ
Suponha que uma amostra, contendo 2 mols de benzeno e 30 mols de oxigênio, é submetida à combustão completa em um sistema fechado.
Considerando-se essas informações, é CORRETO afirmar que, nesse caso, ao final da reação,
A massa desses reagentes e a de seus produtos estão apresentadas neste quadro:
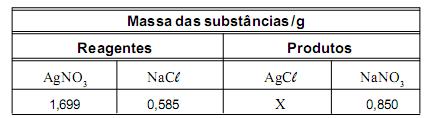
Considere que a reação foi completa e que não há reagentes em excesso.
Assim sendo, é CORRETO afirmar que X – ou seja, a massa de cloreto de prata produzida – é
A 25 °C e 1 atm de pressão, a água é líquida e o sulfeto de hidrogênio é gasoso.
Considerando-se essas informações, é CORRETO afirmar que, na situação descrita, a diferença de estado físico das duas substâncias está relacionada ao fato de
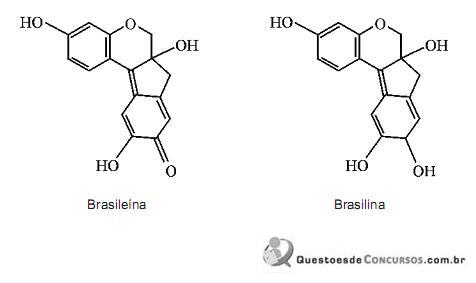
Considerando-se a fórmula estrutural de cada uma dessas duas substâncias, é CORRETO afrmar que a brasileína
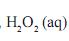 na concentração de 1 mol/L, foi armazenado durante um ano.
na concentração de 1 mol/L, foi armazenado durante um ano.Após esse período, verificou-se que 50% dessa água oxigenada se tinha decomposto, como mostrado nesta equação:
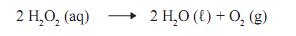
Considerando-se essas informações, é CORRETO afrmar que a massa de oxigênio produzida nesse processo é
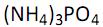 (fosfato de amônio) de concentração 0,10 mol L -1 . Do frasco que continha a solução, foram retirados 25 mL. É INCORRETO afirmar que, nesses 25 mL, pode-se encontrar:
(fosfato de amônio) de concentração 0,10 mol L -1 . Do frasco que continha a solução, foram retirados 25 mL. É INCORRETO afirmar que, nesses 25 mL, pode-se encontrar: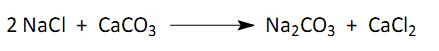
Considerando um rendimento de 100% para cada tonelada de carbonato de cálcio utilizado, a quantidade de carbonato de sódio produzido será:
As reações de formação do dióxido de enxofre e do trióxido de enxofre e as respectivas variações de entalpia, ΔH, são:
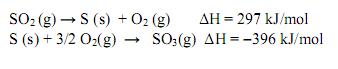
A formação de trióxido de enxofre a partir do dióxido de enxofre é dada pela reação:
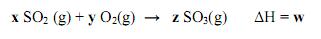
A alternativa que representa os valores indicados por x, y, z e w é:
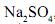 , impura, com massa de 2,53 g, é dissolvida em água. A solução resultante é, então, tratada com cloreto de bário,
, impura, com massa de 2,53 g, é dissolvida em água. A solução resultante é, então, tratada com cloreto de bário, 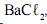 , em excesso. Nessa reação, obtêm-se 2,33 g de sulfato de bário,
, em excesso. Nessa reação, obtêm-se 2,33 g de sulfato de bário, 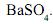
Durante o processo, ocorre a reação química representada nesta equação:
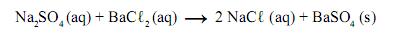
As massas molares das substâncias envolvidas no processo estão representadas neste quadro:
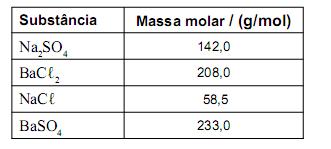
Suponha que a reação ocorre com 100% de rendimento.
Considerando-se essas informações, é CORREtO afrmar que a massa da impureza presente na amostra de sulfato de sódio é de

Tendo em vista os dados apresentados, a espessura da camada de
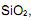 em nanômetros (nm), é igual a:
em nanômetros (nm), é igual a: 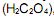 por exemplo, é um composto utilizado para corrigir a concentração de soluções alcalinas por meio da técnica de titulometria. Uma alíquota de 5,0 mL de uma solução de H2C2O4 0,100 mol/L foi titulada com uma solução de NaOH 0,100 mol/L, utilizando-se a fenolftaleí na como indicador. De acordo com a equação química (não balanceada) apresentada a seguir
por exemplo, é um composto utilizado para corrigir a concentração de soluções alcalinas por meio da técnica de titulometria. Uma alíquota de 5,0 mL de uma solução de H2C2O4 0,100 mol/L foi titulada com uma solução de NaOH 0,100 mol/L, utilizando-se a fenolftaleí na como indicador. De acordo com a equação química (não balanceada) apresentada a seguir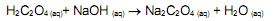
o volume esperado para observação do ponto de viragem é:
Num experimento, foram misturados, em um recipiente, 5 mol de X com 5 mol de Y. Após 1 minuto, nesse recipiente, havia 4 mol de X, 3 mol de Y e 1 mol de Z, como registrado neste quadro:
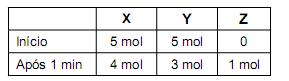
Suponha que essa reação prossegue até o consumo total do reagente limitante.
Considerando-se a quantidade inicial de X e Y, é CORRETO afrmar que a quantidade máxima de Z a ser obtida nessa reação é de
