Questões de Vestibular
Sobre representação das transformações químicas em química
Foram encontradas 889 questões

A partir das informações do texto, julgue o item seguinte.




A partir dessas informações, julgue o itens de 58 a 66, assinale
a opção correta no item 67 e faça o que se pede no item 68, que
é do tipo B.

Com a decomposição de 400kg de calcário, se emitem para a atmosfera

A Lei, à qual Lavoisier faz referência no texto, constitui um fundamento essencial para se compreender e representar as reações químicas. Essa Lei é conhecida como
Considerando que a concentração do ácido derramado é de 98,00 % peso por peso e sua densidade é de 1,84 g/mL, calcule a massa aproximada de CaO necessária para neutralizar 1000 L do ácido derramado.
Com base nas leis ponderais, pode-se afirmar que, segundo:
I a Lei da Conservação da Massa (Lavoisier), 1,0 g de Ferro ao ser oxidado pelo Oxigênio, produz 1,0 g de Óxido Férrico;
II a Lei da Conservação da Massa, ao se usar 16,0 g de Oxigênio molecular para reagir completamente com 40,0 g de Cálcio, são produzidas 56 g de Óxido de Cálcio;
III a Lei das Proporções Definidas, se 1,0 g de Ferro reage com 0,29 g de Oxigênio para formar o composto Óxido Ferroso, 2,0 g de Ferro reagirão com 0,87 g de Oxigênio, produzindo o mesmo composto;
IV a Lei das Proporções Múltiplas, dois mols de Ferro reagem com dois mols de Oxigênio para formar Óxido Ferroso; logo, dois mols de Ferro reagirão com três mols de Oxigênio para formar Óxido Férrico.
Assinale a opção correta.

Com base nessas informações, pode-se afirmar que:
DADOS QUE PODEM SER USADOS NESTA PROVA

Diariamente, um homem elimina pela urina cerca de 30g de ureia (NH2 )2 ) CO, diariamente conforme a figura apresentada.
Com base nessas informações, o número de átomos de nitrogênio que são eliminados diariamente é igual a
A partir dessas informações e dos fatores que afetam a densidade de um material ou de uma substância química, é correto afirmar:
Cu2+(aq) + 2 e- ↠ Cu (s)
A quantidade de elétrons, em mols, necessária para a obtenção de 254g de cobre puro é
Barreiro, E.J.; Bolzani, V.S.; Biodiversidade: fonte potencial para a descoberta de fármacos, Quím. Nova, vol.32 (3), 2009. (adaptado).
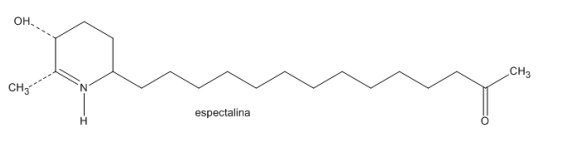
Com base na fórmula estrutural da espectalina mostrada abaixo, obtém-se a massa molar de:
Uma medalha, supostamente de ouro puro, foi testada pelo deslocamento do volume de água contido em uma proveta (recipiente cilíndrico de vidro graduado em cm3 ). Para isso, a medalha, cujo peso era de 57,9 gramas, foi colocada numa proveta de 50 cm 3 que continha 25 cm3 de água e mediu-se o volume de água deslocado na proveta. Sabendo-se que a densidade do ouro puro é de 19,3 g/cm3 , qual será o volume final lido na proveta em cm3 se a medalha for de ouro puro?
Assinale no cartão-resposta o resultado numérico encontrado.
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO QUÍMICO NÚMERO ATÔMICO MASSA ATÔMICA
H 1 1,0
He 2 4,0
Li 3 6,9
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Ne 10 20,2
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Ca 20 40,0
Mn 25 55,0
Co 27 58,9
Zn 30 65,4
Ge 32 72,6
As 33 75,0
Nb 41 93,0
Pb 82 208,0
I. FeS2 + O2 → Fe2(SO4)3 + SO2
II. Fe2(SO4)3 + H2O → Fe(OH)3 + H2SO4
III. H2SO4 + KNO3 → KHSO4 + HNO3
A partir da leitura do texto e da interpretação das equações, assinale com V ou F, conforme sejam verdadeiras ou falsas, as assertivas abaixo.
( ) A equação I traduz uma reação de deslocamento.
( ) A soma dos coeficientes da equação II é 13.
( ) Na equação III, existe um sal ácido.
( ) Na pirita, o nox do ferro é +2.
( ) Para produzir 94,5 kg de ácido nítrico, são necessários 121,5 kg de salitre.
( ) A equação II traduz uma reação de óxido redução.
A sequência correta, de cima para baixo, é:
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO QUÍMICO NÚMERO ATÔMICO MASSA ATÔMICA
H 1 1,0
He 2 4,0
Li 3 6,9
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Ne 10 20,2
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Ca 20 40,0
Mn 25 55,0
Co 27 58,9
Zn 30 65,4
Ge 32 72,6
As 33 75,0
Nb 41 93,0
Pb 82 208,0
Considerando as informações sobre o experimento acima descrito, assinale a única afirmação FALSA.
A densidade é uma propriedade física intensiva utilizada na identificação de substâncias. Matematicamente, a densidade de um determinado material ou de uma substância química é o resultado da divisão da massa pelo volume, que pode ser expresso em, g.cm−3 , em g.L−1 ou em kg.L−1 .
A partir dessas informações e dos fatores que afetam a densidade de um material ou de uma substância química, é correto afirmar:
Leia as informações sobre os pares de compostos:
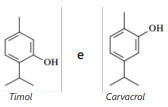
O timol é encontrado abundantemente no óleo essencial do “alecrim-pimenta”, um exemplar típico do Nordeste brasileiro. O carvacrol possui característica pungente e odor aromático, semelhante ao orégano.
 e
e 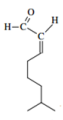
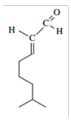
Neral Geranial
O Lemonal (Citral), um aldeído com forte cheiro de limão, encontrado em óleos essenciais de capim-limão, erva cidereira, citronela, etc. é formado por uma mistura de aldeídos como o Neral e o Geranial.
 e
e 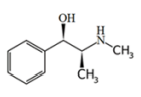
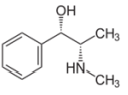
Pseudoefedrina Efedrina
A Pseudoefedrina é um antialérgico de uso oral muito utilizado no tratamento de sintomas associados à rinite alérgica, gripes e resfriados, como coriza, coceira, entupimento do nariz ou lacrimejamento excessivo. Igualmente como a Efedrina pode ser encontrado na composição de certos vegetais como a Ephedra vulgaris (nome científico) e Cipó-de-areia (nome popular).
Com relação a todas as estruturas mostradas acima, são feitas as seguintes afirmações:
I - O Neral e o Geranial são isômeros geométricos. O Geranial é o isômero trans ou E (entegen) e Neral é o isômero cis ou Z (zusammen).
II - O Timol e o Carvacrol são isômeros de cadeia.
III - Tanto o Neral como o Geranial podem ser obtidos por oxidação branda do Nerol e Geraniol.
IV - A Pseudoefedrina e Efedrina são isômeros ópticos e possuem fórmula molecular C10H15NO.
V - Tanto o Neral quanto o Geranial, cujas estruturas foram aqui apresentadas possuem fórmula molecular C9 H15O.
VI - Tanto o Timol quanto o Carvacrol podem sofrer reações de substituição eletrofílica.
Sobre as afirmativas acima podemos dizer que: