Questões de Vestibular
Sobre transformações químicas em química
Foram encontradas 1.209 questões
Ca(HCO3) 2(aq) -> Xs + CO2(g) + H2O
A letra X representa qual sal?
Na 63ª sessão da Assembleia Geral da Organização das Nações Unidas – ONU – foi aprovado e proclamado, para 2011, o Ano Internacional da Química, conferindo à Organização das Nações Unidas para a Educação, a Ciência e a Cultura – UNESCO – e à União Internacional de Química Pura e Aplicada – IUPAC – a coordenação das atividades mundiais para celebrar as grandes descobertas e os últimos avanços científicos e tecnológicos da química.
Dentre os avanços e descobertas, tem-se a descoberta do fósforo pelo alquimista Henning Brandt e, a partir de então, a fabricação dos palitos de fósforo modernos, que acendem em qualquer lugar: os chamados fósforos de segurança. Eles são armazenados em uma caixa revestida nas laterais por uma cobertura de fósforo vermelho (Pn ) – menos perigoso que o fósforo branco (P4 ) – e sulfeto de antimônio (Sb2 S3 ). A cabeça do fósforo é coberta com clorato de potássio (KClO3 ) e cola e, ao ser riscada na caixa, entra em ignição, liberando energia na forma de fogo.
Sobre as substâncias usadas na fabricação do fósforo de segurança, assinale a alternativa correta.
Áreas como a medicina, a agricultura e a indústria farmacêutica são beneficiadas com o desenvolvimento dos estudos da radioatividade. A radioterapia – técnica utilizada para destruir células cancerosas – faz uso, principalmente, de radioisótopos do iodo-131 para eliminar lesões identificadas nos radiodiagnósticos da tireoide.
Sobre esse radioisótopo, assinale a alternativa correta.
( ) CaCO3(aq) ( ) NaOH(aq) diluído na presença de fenolftaleína ( ) limalha fina de Zn(s)
1 – mudança de cor 2 – formação de gás 3 – desaparecimento do material sólido 4 – formação de precipitado
Associando a coluna da direita com a da esquerda, a sequência correta de números é
Assinale a alternativa que melhor representa a variação da pressão (p) exercida pelo gás, em função da variação do volume (V) do recipiente.
 têm-se mostrado
promissoras devido ao potencial terapêutico comprovado
em cobaias. Sobre um átomo eletricamente neutro do elemento químico ouro, verifica-se que no núcleo há
têm-se mostrado
promissoras devido ao potencial terapêutico comprovado
em cobaias. Sobre um átomo eletricamente neutro do elemento químico ouro, verifica-se que no núcleo há Assinale a alternativa correta.
Nas equações abaixo, representadas na forma simplificada, há espécies ionizadas (não mostradas nessa forma) que participam das reações enquanto outras não:
I. KCℓ(aq) + AgNo3(aq) -> AgCℓ(s) + KNO3(aq)
I. FeCℓ3(aq) + SnCℓ2(aq) -> FeCℓ2(aq) + SnCℓ4(aq)
III. Ba(OH)2(aq) + H2SO4(aq) -> BaSo4(s) + H20(ℓ)
Nessas equações, os símbolos (aq), (s) e (ℓ) representam, respectivamente, “espécies químicas dissolvidas em água”, “espécies químicas no estado sólido” e “espécies químicas no estado líquido”.
É correto afirmar que, na reação indicada, são íons espectadores
Considerando as informações do texto, têm-se as seguintes afirmativas: I - O suor é uma mistura heterogênea do tipo suspensão. II - A densidade do suor é a razão entre seu volume e sua massa e representa uma propriedade química. III - O suor sobre a pele desaparece quando o atleta pára de jogar, porque retira energia térmica do corpo para transformar seu estado físico de líquido para gasoso. IV - Os íons sódio e potássio, contidos no suor, são metais alcalinos e pertencem ao primeiro grupo da tabela periódica. V - Os íons sódio, potássio e magnésio, liberados durante a transpiração, possuem cargas iguais a +1, +1 e +2, respectivamente.
Assinale a alternativa que reúne somente afirmativas corretas.
DADOS QUE PODEM SER USADOS NESTA PROVA

DADOS QUE PODEM SER USADOS NESTA PROVA

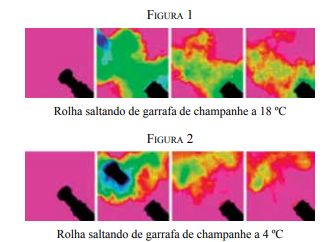
(Pesquisa Fapesp, janeiro de 2013. Adaptado.)
As figuras permitem observar diferenças no espocar de um champanhe: a 18 ºC, logo no início, observa-se que o volume de CO2 disperso na nuvem gasosa – não detectável na faixa da luz visível, mas sim do infravermelho – é muito maior do que quando a temperatura é de 4 ºC. Numa festa de fim de ano, os estudantes utilizaram os dados desse experimento para demonstrar a lei que diz:
