Questões de Vestibular
Sobre transformações químicas em química
Foram encontradas 1.180 questões
O cinamaldeído é um dos principais compostos que dão o sabor e o aroma da canela. Quando exposto ao ar, oxida conforme a equação balanceada:
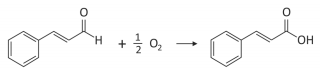
Uma amostra de 19,80 g desse composto puro foi exposta ao ar por 74 dias e depois pesada novamente, sendo que a massa final aumentou em 1,20 g. A porcentagem desse composto que foi oxidada no período foi de
Note e adote:
Massas molares (g/mol):
Cinamaldeído = 132; O2 = 32
Considere que não houve perda de cinamaldeído ou do produto de oxidação por evaporação.
Diferentes métodos são utilizados por profissionais da área de Ciência Forense para determinar a quanto tempo o indivíduo veio a óbito. Pesquisadores brasileiros reportaram que existe uma relação linear entre a concentração de Fe2+ no corpo vítreo do olho com o intervalo pós-morte. Este método é baseado em uma reação de Fe2+ com orto-fenantrolina como agente cromogênico realizada em um dispositivo de papel, cujo produto da reação apresenta coloração alaranjada. Desta forma, quanto maior o tempo de intervalo pós-morte maior a intensidade de coloração do produto.
(Adaptado de: GARCIA, P.T.; GABRIEL, E.F.M.; PESSÔA, G.S.; SANTOS JUNIOR, J.C.; MOLLO FILHO, P. C.; GUIDUGLI, R.B.F.; HÖEHR, N.F.; ARRUDA, M.A.Z.; COLTRO, W.K.T, Analytica Chimica Acta, v. 974, n.29, p.69-74, 2017).
A equação química da reação de Fe2+ com orto-fenantrolina é apresentada na figura seguir.
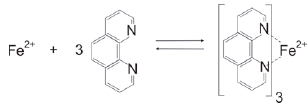
Considerando os conceitos, as definições de ácido e base e a reação química apresentada, assinale a alternativa correta.
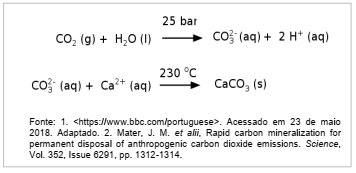
A usina de energia de Hellisheidi, na Islândia, vem testando um novo método para combater o aquecimento global: transformar o gás carbônico (CO2) em pedra. O processo ocorre em duas etapas: primeiro o CO2 é dissolvido em água em altas pressões (25 bar) e depois injetado no solo numa temperatura de 230 °C. A mineralização do gás carbônico ocorre de maneira rápida, devido à reatividade e composição do solo da região, rica em ferro, cálcio e magnésio. As duas etapas da remoção de CO2 estão esquematizadas de maneira simplificada ao lado.
A remoção desse gás da atmosfera ocorre por:
Dois grandes grupos de substâncias compõem as células, as substâncias orgânicas e as inorgânicas, sendo as inorgânicas representadas pela água e pelos sais minerais. Os sais minerais atuam no corpo humano na contração muscular, coagulação sanguínea, síntese de proteínas etc. Entre os elementos que são importantes nos sais minerais, podemos citar, 20Ca, 11Na, 12Mg, 26Fe, 30Zn, 24Cr e 25Mn.
Considerando os elementos acima, assinale a alternativa correta.
HABER-BOSCH: O PROCESSO RESPONSÁVEL POR ALIMENTAR
MUITA GENTE NESTE PLANETA
Estima-se que aproximadamente 45% da população mundial só estão aqui em função do desenvolvimento do processo Haber-Bosch e da produção de amônia. Sem os fertilizantes nitrogenados, nós não teríamos condições de produzir a quantidade de alimentos necessária para alimentar a população que temos hoje no mundo, que está em torno de 7,3 bilhões de pessoas, com tendência a chegar a 9 ou 10 bilhões por volta de 2050. O processo Haber-Bosh descreve uma técnica para obtenção da amônia a partir do nitrogênio do ar atmosférico e do hidrogênio e de fatores como altas temperaturas e pressão.
Disponível em:<https://www.acontecenoticias.com.br/single-post/2017/09/27/Haber-Bosch-O-Processo-Respons%C3%A1velpor-Alimentar-Muita-Gente-Neste-Planeta> . Acesso em: 01/04/18.
A equação não balanceada que descreve a reação de produção de amônia é mostrada a seguir:
N2(g) +H2(g) ⇌ NH3(g)
Ao reagir 50 mols de N2 e 30 mols de H2, qual a quantidade de NH3 produzida em gramas se a reação de síntese for completa?
Dados: N=14 g/mol; H=1g/mol
Uma reação química ocorre quando as ligações entre os átomos das substâncias iniciais (reagentes) são rompidas e são reestabelecidas de outra maneira, formando os produtos. As reações químicas são comuns no nosso cotidiano e muitas vezes podem ser confirmadas por meio de evidências macroscópicas, como desprendimento de gás, mudança de cor, formação ou dissolução de precipitado. A seguir, estão descritas algumas situações do cotidiano:
I. Formação da neve.
II. Queima de um pedaço de papel.
III. Formação da ferrugem.
IV. Sublimação do iodo.
V. Dissolução de sal de cozinha em água.
VI. Amadurecimento de uma fruta.
Assinale a alternativa que contém somente situações que envolvem reações químicas:
O ácido sulfúrico, um dos compostos mais importantes do ponto de vista industrial no mundo moderno, pode reagir com diversas substâncias.
Na coluna da esquerda abaixo, estão relacionadas substâncias que reagem com o ácido sulfúrico; na da direita, forças motrizes que favorecem a ocorrência das reações.
Associe a coluna da direita à da esquerda.
( ) KNO2
( ) Na2CO3
( ) Ba(NO3)2
1 - forma gás
2 - forma ácido fraco
3 - forma precipitado
4 - forma um sal básico
Na coluna da direita, estão listados cinco elementos da tabela periódica; na da esquerda, a classificação desses elementos.
Associe a coluna da direita à da esquerda.
( ) Alcalino
( ) Halogênio
( ) Alcalino terroso
( ) Elemento de transição
1 - Magnésio
2 - Potássio
3 - Paládio
4 - Bromo
5 - Xenônio
A sequência correta de preenchimento dos parênteses, de cima para baixo, é
Considere as seguintes afirmações a respeito do experimento de Rutherford e do modelo atômico de Rutherford-Bohr.
I - A maior parte do volume do átomo é constituída pelo núcleo denso e positivo.
II - Os elétrons movimentam-se em órbitas estacionárias ao redor do núcleo.
III- O elétron, ao pular de uma órbita mais externa para uma mais interna, emite uma quantidade de energia bem definida.
Quais estão corretas?
Em 1915, o exército alemão utilizou, pela primeira vez, bombas de gás cloro contra trincheiras francesas e argelinas, causando a morte em mais de 5 mil soldados. O cloro gasoso pode ser utilizado na fabricação de solventes clorados, inseticidas (DDT), purificação de água, produção de compostos inorgânicos como hipoclorito de sódio (NaOCl), cloretos metálicos. Uma forma de produzir cloro gasoso em pequenas quantidades é pela reação entre permanganato de potássio e ácido clorídrico, apresentada a seguir:
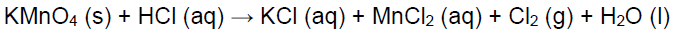
Sobre essa reação, analise as proposições.
I. Trata-se de uma reação de oxirredução, em que o cloreto sofre oxidação e o manganês sofre redução.
II. A reação está balanceada.
III. A reação não está balanceada, sendo os coeficientes estequiométricos para essa reação 2:16:2:2:5:8.
IV. O estado de oxidação do átomo de manganês passa de 7+ para 2+, nessa reação, tratando-se de uma redução.
V. O cloreto é o agente redutor nesta reação.
Assinale a alternativa correta.
