Questões de Vestibular
Sobre transformações químicas em química
Foram encontradas 1.180 questões

O teste de chamas é um experimento realizado principalmente ao se estudar o conceito do
modelo atômico de Rutherford-Böhr.
Com base nos conhecimentos sobre estrutura atômica e propriedades periódicas, é correto afirmar:
No processo de ionização, um átomo neutro recebe um elétron, liberando energia.

O teste de chamas é um experimento realizado principalmente ao se estudar o conceito do
modelo atômico de Rutherford-Böhr.
Com base nos conhecimentos sobre estrutura atômica e propriedades periódicas, é correto afirmar:
De acordo com Böhr, o elétron passa de uma órbita mais externa para uma mais interna quando recebe
energia.

O teste de chamas é um experimento realizado principalmente ao se estudar o conceito do
modelo atômico de Rutherford-Böhr.
Com base nos conhecimentos sobre estrutura atômica e propriedades periódicas, é correto afirmar:
As experiências de Rutherford mostraram que o tamanho do núcleo de um átomo é muito pequeno em
relação ao tamanho do átomo.

O teste de chamas é um experimento realizado principalmente ao se estudar o conceito do
modelo atômico de Rutherford-Böhr.
Com base nos conhecimentos sobre estrutura atômica e propriedades periódicas, é correto afirmar:
A carga nuclear efetiva Zef experimentada pelo elétron é sempre maior que a carga nuclear nominal.

O teste de chamas é um experimento realizado principalmente ao se estudar o conceito do
modelo atômico de Rutherford-Böhr.
Com base nos conhecimentos sobre estrutura atômica e propriedades periódicas, é correto afirmar:
Isótopos são átomos com o mesmo número de massa.
O isótopo do elemento césio de número de massa 137 sofre decaimento segundo a equação:
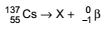
O número atômico do isótopo que X representa é igual a
INSTRUÇÃO: Para responder à questão, analise o texto a seguir.
A energia eólica é a energia dos ventos, mas sua origem é a energia solar. Estima-se que 1 a 2% da energia solar converta-se em energia eólica. Isso porque a terra é aquecida pelo sol de forma irregular, gerando diferentes pressões atmosféricas em lugares distintos. O vento é o movimento do ar dos lugares com pressão mais alta para os de pressão mais baixa.
O aproveitamento da energia eólica em aerogeradores
é possível porque
“O ácido Sulfúrico é tido como um indicador da economia de um país, pois é o produto químico mais utilizado
pela indústria. Sua aplicação tem larga escala, desde em fertilizantes e baterias de automóveis, até
no refino do petróleo. É extremamente solúvel em água, porém, isto deve ser feito com muita cautela,
pois seus vapores são liberados agressivamente”.
Disponível em: <http://www.brasilescola.com/> .
Uma das maneiras de produzi-lo é através das reações com oxigênio, o qual ocupa uma fração de 21%, aproximadamente, no ar atmosférico. A partir das informações fornecidas e utilizando as reações não balanceadas apresentadas a seguir, referentes às etapas de produção de ácido sulfúrico, assinale a alternativa CORRETA.
Dados: (Ma (g/mol): H = 1, O = 16, S= 32). Volume molar na CNTP: 22,71 L/mol, Avogadro = 6X1023
I) S8(s) + O2(g) → SO2(g)
II) SO2(g)+ O2(g) → SO3(g)
III) SO3(g) + H2O (l) → H2SO4 (aq)
O ácido permangânico é um composto instável, de cor branca, extremamente corrosivo, o qual oxida em soluções aquosas. Já o hidróxido de ferro III é uma base insolúvel em água que, em conjunto com outras substâncias, pode servir, por exemplo, em medicina para ajudar a tratar anemias.
Disponível em: <http://www.quimica.seed.pr.gov.br> .
No que diz respeito aos ácidos e bases, assinale a alternativa CORRETA.
Dadas massas atômicas em (g/mol): H = 1, O = 16, Mn = 55, Fe = 56
O sulfato de potássio e o permanganato de potássio são duas importantes substâncias. O sulfato de potássio é utilizado na agricultura como um dos constituintes dos fertilizantes, pois ajuda na adubação das culturas que estão com carência de potássio, ao passo que o permanganato de potássio é utilizado no tratamento da catapora, pois ajuda a secar os ferimentos causados pela doença. A reação a seguir mostra uma maneira de produzir o sulfato de potássio a partir do permanganato de potássio. Considerando as informações apresentadas e a análise da reação não balanceada, assinale a alternativa CORRETA.
Dados: massas atômicas em (g/mol): H= 1, O= 16, S = 32, K = 39, Mn = 55
KMnO4(aq) + H2SO4(aq) + H2O2(aq) → K2SO4(aq) + H2O(l) + MnSO4(aq) + O2(g)
Relacione corretamente as equações com as reações químicas do cotidiano apresentadas abaixo, numerando a Coluna II de acordo com a Coluna I.
Coluna I
(1) 2NaHCO3 →Na2CO3 + CO2 + H2O
(2) Mg(OH)2 + CO2→MgCO3 + H2O
(3) 2NH3 + CO2 →CO(NH2)2 + H2O
(4) NaHCO3 + HCℓ→NaCℓ + H2CO3
Coluna II
( ) Produção de substância usada como fertilizante.
( ) Ação do sal de fruta no estômago humano.
( ) Feitura do bolo de chocolate.
( ) Absorção
do gás de
ambientes
fechados.
A sequência correta, de cima para baixo, é:
TEXTO 8
IX
Horas depois, teve Rubião um pensamento horrível. Podiam crer que ele próprio incitara o amigo à viagem, para o fim de o matar mais depressa, e entrar na posse do legado, se é que realmente estava incluso no testamento. Sentiu remorsos. Por que não empregou todas as forças, para contê-lo? Viu o cadáver do Quincas Borba, pálido, hediondo, fitando nele um olhar vingativo; resolveu, se acaso o fatal desfecho se desse em viagem, abrir mão do legado.
Pela sua parte o cão vivia farejando, ganindo, querendo fugir; não podia dormir quieto, levantava-se muitas vezes, à noite, percorria a casa, e tornava ao seu canto. De manhã, Rubião chamava-o à cama, e o cão acudia alegre; imaginava que era o próprio dono; via depois que não era, mas aceitava as carícias, e fazia-lhe outras, como se Rubião tivesse de levar as suas ao amigo, ou trazê-lo para ali. Demais, havia-se-lhe afeiçoado também, e para ele era a ponte que o ligava à existência anterior. Não comeu durante os primeiros dias. Suportando menos a sede, Rubião pôde alcançar que bebesse leite; foi a única alimentação por algum tempo. Mais tarde, passava as horas, calado, triste, enrolado em si mesmo, ou então com o corpo estendido e a cabeça entre as mãos.
Quando o médico voltou, ficou espantado da temeridade do doente; deviam tê-lo impedido de sair; a morte era certa.
— Certa?
— Mais tarde ou mais cedo. Levou o tal cachorro?
— Não, senhor, está comigo; pediu que cuidasse dele, e chorou, olhe que chorou que foi um nunca acabar. Verdade é, disse ainda Rubião para defender o enfermo, verdade é que o cachorro merece a estima do dono; parece gente.
O médico tirou o largo chapéu de palha para concertar a fita; depois sorriu. Gente? Com que então parecia gente? Rubião insistia, depois explicava; não era gente como a outra gente, mas tinha coisas de sentimento, e até de juízo. Olhe, ia contar-lhe uma...
— Não, homem, não, logo, logo, vou a um doente de erisipela... Se vierem cartas dele, e não forem reservadas, desejo vê-las, ouviu? E lembranças ao cachorro, concluiu saindo.
Algumas pessoas começaram a mofar do Rubião e da singular incumbência de guardar um cão em vez de ser o cão que o guardasse a ele. Vinha a risota, choviam as alcunhas. Em que havia de dar o professor! sentinela de cachorro! Rubião tinha medo da opinião pública. Com efeito, parecia-lhe ridículo; fugia aos olhos estranhos, olhava com fastio para o animal, dava-se ao diabo, arrenegava da vida. Não tivesse a esperança de um legado, pequeno que fosse. Era impossível que lhe não deixasse uma lembrança.
(ASSIS, Machado de. Quincas Borba. São Paulo: Ática, 2011. p. 30-31.)
Note e adote: Composição aproximada do ar em volume: 80% de N2 e 20% de O2.
Em uma aula experimental, dois grupos de alunos (G1 e G2) utilizaram dois procedimentos diferentes para estudar a velocidade da reação de carbonato de cálcio com excesso de ácido clorídrico. As condições de temperatura e pressão eram as mesmas nos dois procedimentos e, em cada um deles, os estudantes empregaram a mesma massa inicial de carbonato de cálcio e o mesmo volume de solução de ácido clorídrico de mesma concentração.
O grupo G1 acompanhou a transformação ao longo do tempo, realizada em um sistema aberto, determinando a variação de massa desse sistema (Figura 1 e Tabela).
O grupo G2 acompanhou essa reação ao longo do tempo, porém determinando o volume de dióxido de carbono recolhido (Figura 2).
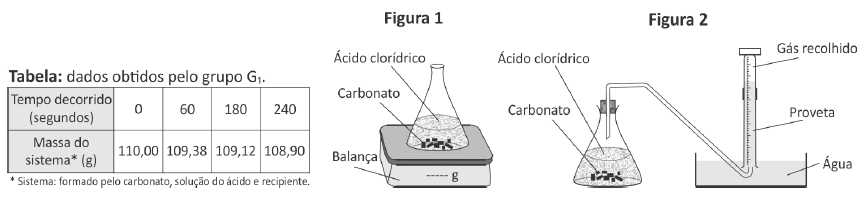
Comparando os dois experimentos, os volumes aproximados de CO2, em litros, recolhidos pelo grupo G2 após 60, 180 e 240 segundos devem ter sido, respectivamente,
Note e adote:
massa molar do CO2: 44 g/mol;
volume molar do CO2: 24 L/mol;
desconsidere a solubilidade do CO2 em água.

