Questões de Vestibular
Sobre transformações químicas em química
Foram encontradas 1.209 questões
O airbag é um equipamento de segurança na forma de bolsas infláveis que protege os ocupantes de veículos em caso de acidente e tem como princípio fundamental reações químicas. Esse dispositivo é constituído de pastilhas contendo azida de sódio e nitrato de potássio, que são acionadas quando a unidade de controle eletrônico envia um sinal elétrico para o ignitor do gerador de gás. A reação de decomposição da azida de sódio (NaN3) ocorre a 300 °C e é instantânea, mais rápida que um piscar de olhos, cerca de 20 milésimos de segundo, e desencadeia a formação de sódio metálico e nitrogênio molecular, que rapidamente inflam o balão do airbag. O nitrogênio formado na reação é um gás inerte, não traz nenhum dano à saúde, mas o sódio metálico é indesejável. Como é muito reativo, acaba se combinando com o nitrato de potássio, formando mais nitrogênio gasoso e óxidos de sódio e potássio, segundo as reações a seguir:
NaN3 → Na + N2
Na + KNO3 → K2O + Na2O + N2
Considerando uma pastilha de 150 g de azida de sódio com 90% de pureza, o volume aproximado de gás nitrogênio produzido nas condições ambientes é de:
Dados: Volume molar de gás nas condições ambientes = 25 L/mol e massa molar do NaN3 = 65 g/mol.
Analise a questão abaixo.
Reações no estado gasoso com Δn>0 apresentam ΔS>0.

O teste de chamas é um experimento realizado principalmente ao se estudar o conceito do
modelo atômico de Rutherford-Böhr.
Com base nos conhecimentos sobre estrutura atômica e propriedades periódicas, é correto afirmar:
Os raios iônicos variam da sequência Na+> Mg2+> Al3+.

O teste de chamas é um experimento realizado principalmente ao se estudar o conceito do
modelo atômico de Rutherford-Böhr.
Com base nos conhecimentos sobre estrutura atômica e propriedades periódicas, é correto afirmar:
A eletroafinidade do átomo de potássio é maior que a do átomo de cloro.

O teste de chamas é um experimento realizado principalmente ao se estudar o conceito do
modelo atômico de Rutherford-Böhr.
Com base nos conhecimentos sobre estrutura atômica e propriedades periódicas, é correto afirmar:
A distribuição eletrônica do átomo do tungstênio apresenta elétrons mais energéticos no subnível 5d e
elétrons mais externos no subnível 6s.

O teste de chamas é um experimento realizado principalmente ao se estudar o conceito do
modelo atômico de Rutherford-Böhr.
Com base nos conhecimentos sobre estrutura atômica e propriedades periódicas, é correto afirmar:
No processo de ionização, um átomo neutro recebe um elétron, liberando energia.

O teste de chamas é um experimento realizado principalmente ao se estudar o conceito do
modelo atômico de Rutherford-Böhr.
Com base nos conhecimentos sobre estrutura atômica e propriedades periódicas, é correto afirmar:
De acordo com Böhr, o elétron passa de uma órbita mais externa para uma mais interna quando recebe
energia.

O teste de chamas é um experimento realizado principalmente ao se estudar o conceito do
modelo atômico de Rutherford-Böhr.
Com base nos conhecimentos sobre estrutura atômica e propriedades periódicas, é correto afirmar:
As experiências de Rutherford mostraram que o tamanho do núcleo de um átomo é muito pequeno em
relação ao tamanho do átomo.

O teste de chamas é um experimento realizado principalmente ao se estudar o conceito do
modelo atômico de Rutherford-Böhr.
Com base nos conhecimentos sobre estrutura atômica e propriedades periódicas, é correto afirmar:
A carga nuclear efetiva Zef experimentada pelo elétron é sempre maior que a carga nuclear nominal.

O teste de chamas é um experimento realizado principalmente ao se estudar o conceito do
modelo atômico de Rutherford-Böhr.
Com base nos conhecimentos sobre estrutura atômica e propriedades periódicas, é correto afirmar:
Isótopos são átomos com o mesmo número de massa.
O isótopo do elemento césio de número de massa 137 sofre decaimento segundo a equação:
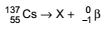
O número atômico do isótopo que X representa é igual a
INSTRUÇÃO: Para responder à questão, analise o texto a seguir.
A energia eólica é a energia dos ventos, mas sua origem é a energia solar. Estima-se que 1 a 2% da energia solar converta-se em energia eólica. Isso porque a terra é aquecida pelo sol de forma irregular, gerando diferentes pressões atmosféricas em lugares distintos. O vento é o movimento do ar dos lugares com pressão mais alta para os de pressão mais baixa.
O aproveitamento da energia eólica em aerogeradores
é possível porque
“O ácido Sulfúrico é tido como um indicador da economia de um país, pois é o produto químico mais utilizado
pela indústria. Sua aplicação tem larga escala, desde em fertilizantes e baterias de automóveis, até
no refino do petróleo. É extremamente solúvel em água, porém, isto deve ser feito com muita cautela,
pois seus vapores são liberados agressivamente”.
Disponível em: <http://www.brasilescola.com/> .
Uma das maneiras de produzi-lo é através das reações com oxigênio, o qual ocupa uma fração de 21%, aproximadamente, no ar atmosférico. A partir das informações fornecidas e utilizando as reações não balanceadas apresentadas a seguir, referentes às etapas de produção de ácido sulfúrico, assinale a alternativa CORRETA.
Dados: (Ma (g/mol): H = 1, O = 16, S= 32). Volume molar na CNTP: 22,71 L/mol, Avogadro = 6X1023
I) S8(s) + O2(g) → SO2(g)
II) SO2(g)+ O2(g) → SO3(g)
III) SO3(g) + H2O (l) → H2SO4 (aq)
O ácido permangânico é um composto instável, de cor branca, extremamente corrosivo, o qual oxida em soluções aquosas. Já o hidróxido de ferro III é uma base insolúvel em água que, em conjunto com outras substâncias, pode servir, por exemplo, em medicina para ajudar a tratar anemias.
Disponível em: <http://www.quimica.seed.pr.gov.br> .
No que diz respeito aos ácidos e bases, assinale a alternativa CORRETA.
Dadas massas atômicas em (g/mol): H = 1, O = 16, Mn = 55, Fe = 56
O sulfato de potássio e o permanganato de potássio são duas importantes substâncias. O sulfato de potássio é utilizado na agricultura como um dos constituintes dos fertilizantes, pois ajuda na adubação das culturas que estão com carência de potássio, ao passo que o permanganato de potássio é utilizado no tratamento da catapora, pois ajuda a secar os ferimentos causados pela doença. A reação a seguir mostra uma maneira de produzir o sulfato de potássio a partir do permanganato de potássio. Considerando as informações apresentadas e a análise da reação não balanceada, assinale a alternativa CORRETA.
Dados: massas atômicas em (g/mol): H= 1, O= 16, S = 32, K = 39, Mn = 55
KMnO4(aq) + H2SO4(aq) + H2O2(aq) → K2SO4(aq) + H2O(l) + MnSO4(aq) + O2(g)
