Questões de Vestibular
Sobre transformações químicas em química
Foram encontradas 1.192 questões
I. O átomo é constituído por duas regiões distintas: o núcleo e a eletrosfera.
II. O núcleo atômico é extremamente pequeno em relação ao tamanho do átomo.
III. O átomo tem uma região em que existe muito espaço vazio.
IV. As partículas negativas do átomo podem ter quaisquer valores de energia.
V. A eletrosfera é a região que concentra praticamente toda a massa elétrica do átomo.
No que diz respeito à estrutura da matéria, corresponde às conclusões de Rutherford o que se afirma em

O teste de chamas é um experimento realizado principalmente ao se estudar o conceito do modelo atômico de Rutherford-Böhr.
Com base nos conhecimentos sobre estrutura atômica e propriedades periódicas, é correto afirmar:
O urânio 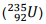 é um elemento químico radioativo utilizado na construção da bomba atômica lançada na cidade
de Hiroshima, no Japão, durante a Segunda Guerra Mundial. O átomo de urânio apresenta:
é um elemento químico radioativo utilizado na construção da bomba atômica lançada na cidade
de Hiroshima, no Japão, durante a Segunda Guerra Mundial. O átomo de urânio apresenta:
A configuração eletrônica para os elementos A e B são apresentadas a seguir:
A = 1s2 2s2 2p6 3s2 B = 1s2 2s2 2p6 3s2 3p5
De posse dessas informações, assinale a afirmativa INCORRETA.
I. O átomo possui duas regiões: o núcleo e a eletrosfera. II. Os elétrons estão em movimento circular, com velocidade e posição bem definidas. III. A orbital é uma região de maior probabilidade de se encontrar um elétron. IV. Toda a massa do átomo é praticamente concentrada no núcleo.
As alternativas CORRETAS são:
DADOS QUE PODEM SER USADOS NESTA PROVA

DADOS QUE PODEM SER USADOS NESTA PROVA

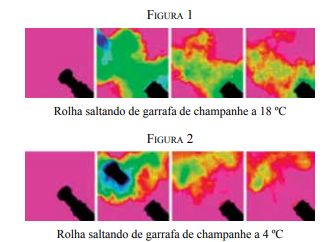
(Pesquisa Fapesp, janeiro de 2013. Adaptado.)
As figuras permitem observar diferenças no espocar de um champanhe: a 18 ºC, logo no início, observa-se que o volume de CO2 disperso na nuvem gasosa – não detectável na faixa da luz visível, mas sim do infravermelho – é muito maior do que quando a temperatura é de 4 ºC. Numa festa de fim de ano, os estudantes utilizaram os dados desse experimento para demonstrar a lei que diz:
Analise a questão abaixo.
Reações no estado gasoso com Δn>0 apresentam ΔS>0.

O teste de chamas é um experimento realizado principalmente ao se estudar o conceito do
modelo atômico de Rutherford-Böhr.
Com base nos conhecimentos sobre estrutura atômica e propriedades periódicas, é correto afirmar:
Os raios iônicos variam da sequência Na+> Mg2+> Al3+.

O teste de chamas é um experimento realizado principalmente ao se estudar o conceito do
modelo atômico de Rutherford-Böhr.
Com base nos conhecimentos sobre estrutura atômica e propriedades periódicas, é correto afirmar:
A eletroafinidade do átomo de potássio é maior que a do átomo de cloro.

O teste de chamas é um experimento realizado principalmente ao se estudar o conceito do
modelo atômico de Rutherford-Böhr.
Com base nos conhecimentos sobre estrutura atômica e propriedades periódicas, é correto afirmar:
A distribuição eletrônica do átomo do tungstênio apresenta elétrons mais energéticos no subnível 5d e
elétrons mais externos no subnível 6s.