Questões de Vestibular
Sobre transformações químicas em química
Foram encontradas 1.180 questões
Analise o gráfico que mostra a variação da eletronegatividade em função do número atômico.
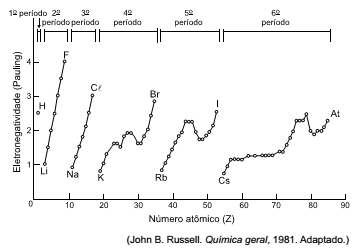
Devem unir-se entre si por ligação iônica os elementos de
números atômicos
Dos extensos efeitos nocivos que a radiação ionizante provoca na matéria viva, afigura-se a geração de radicais livres, que são espécies químicas eletricamente neutras que apresentam um ou mais elétrons desemparelhados na camada de valência. O íon cloreto, por exemplo, que, quantitativamente, constitui o principal ânion do plasma, transforma-se no radical livre Cℓ●, com 7 elétrons na camada de valência, podendo, assim, reagir facilmente com as biomoléculas, alterando o comportamento bioquímico de muitas proteínas solúveis do meio sanguíneo e também os constituintes membranários de células: hemácias, leucócitos, plaquetas.
(José Luiz Signorini e Sérgio Luís Signorini. Atividade física e radicais livres, 1993. Adaptado.)
Ao transformar-se em radical livre, o ânion cloreto
O cloreto de cobalto(II) anidro, CoCℓ2 , é um sal de cor azul, que pode ser utilizado como indicador de umidade, pois torna-se rosa em presença de água. Obtém-se esse sal pelo aquecimento do cloreto de cobalto(II) hexa-hidratado, CoCℓ2 .6H2O, de cor rosa, com liberação de vapor de água.
sal hexa-hidratado (rosa) 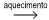 sal anidro (azul) + vapor de água
sal anidro (azul) + vapor de água
A massa de sal anidro obtida pela desidratação completa de 0,1 mol de sal hidratado é, aproximadamente,
O quadro fornece indicações sobre a solubilidade de alguns compostos iônicos inorgânicos em água a 20 ºC.
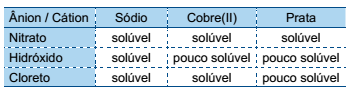
Em um laboratório, uma solução aquosa obtida a partir da
reação de uma liga metálica com ácido nítrico contém nitrato
de cobre(II) e nitrato de prata. Dessa solução, pretende-se
remover, por precipitação, íons de prata e íons de cobre(II),
separadamente. Para tanto, pode-se adicionar à mistura uma
solução aquosa de
Na formulação da calda bordalesa fornecida pela EMATER, recomenda-se um teste para verificar se a calda ficou ácida: coloca-se uma faca de aço carbono na solução por três minutos. Se a lâmina da faca adquirir uma coloração marrom ao ser retirada da calda, deve-se adicionar mais cal à mistura. Se não ficar marrom, a calda está pronta para o uso. De acordo com esse teste, conclui-se que a cal deve promover
Dados de massas molares em g∙mol-1: sulfato de cobre (II) pentaidratado = 250; hidróxido de cálcio = 74.
Bicarbonato de sódio sólido aquecido se decompõe, produzindo carbonato de sódio sólido, além de água e dióxido de carbono gasosos. O gráfico mostra os resultados de um experimento em que foram determinadas as massas de carbonato de sódio obtidas pela decomposição de diferentes massas de bicarbonato de sódio.
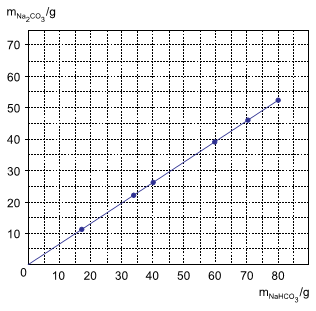
Os dados do gráfico permitem concluir que as massas de
carbonato de sódio e bicarbonato de sódio nessa reação
estão relacionadas pela equação 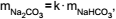 e
que o valor aproximado de k é
e
que o valor aproximado de k é
Considerando a equação de formação da glicose não balanceada C + H2 + O2 → C6H12O6 , atente às seguintes equações:
I. C + O2 → CO2 ΔH = −94,1 kcal
II. H2 + ½ O2 → H2O ΔH = −68,3 kcal
III. C6H12O6 + 6O2 → 6CO2 + 6 H2O ΔH = −673,0 kcal
A massa de glicose formada a partir da reação de 14,4 g de carbono e sua entalpia de formação em kcal/mol serão, respectivamente,
Em um laboratório químico, foi encontrado um frasco de vidro contendo um líquido incolor e que apresentava o seguinte rótulo:
Para identificar a substância contida no frasco, foram feitos os seguintes testes:
I. Dissolveram-se alguns mililitros do líquido do frasco em água, resultando uma solução neutra. A essa solução, adicionaram-se uma gota de ácido e uma pequena quantidade de um forte oxidante. Verificou-se a formação de um composto branco insolúvel em água fria, mas solúvel em água quente. A solução desse composto em água quente apresentou pH = 4.
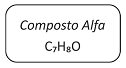
II. O sólido branco, obtido no teste anterior, foi dissolvido em etanol e a solução foi aquecida na presença de um catalisador. Essa reação produziu benzoato de etila, que é um éster aromático, de fórmula C9H10O2.
Com base nos resultados desses testes, concluiu-se que o
Composto Alfa é:
Analise a tabela periódica e as seguintes afirmações a respeito do elemento químico enxofre (S):
I. Tem massa atômica maior do que a do selênio (Se).
II. Pode formar com o hidrogênio um composto molecular de fórmula H2S.
III. A energia necessária para remover um elétron da camada mais externa do enxofre é maior do que para o sódio (Na).
IV. Pode formar com o sódio (Na) um composto iônico de fórmula Na3S.
São corretas apenas as afirmações
Na Onda do Sódio
Eu sou o Sódio,
não tenho ódio.
Quando estou com a água,
não guardo mágoa.
Explodo de emoção,
nessa reação.
Não esbanjo meu potencial,
sou muito legal.
Minha família é a um,
me dou bem com cada um.
Meu período é o terceiro,
de quem eu sou parceiro.
Existe um halogênio especial,
me ligo a todos, mas com o cloro...
Eu adoro!
Que união genial!
Me envolvo em muitas reações,
com diferentes emoções.
Base, cátion, sal...
Eu sou mesmo radical!
(Poesia de autoria de equipe participante da Gincana de Química (2011) da
Universidade Federal do Ceará. Disponível em:<http://www.quimica.ufc.br>
Acerca das informações químicas do elemento sódio que podem ser extraídas do texto “Na onda do sódio”, considere as seguintes afirmativas:
1. Da afirmativa “Minha família é a um”, pode-se concluir que sódio pertence à família I e, portanto, possui configuração eletrônica finalizada em ns1 .
2. Da afirmativa “Meu período é o terceiro”, interpreta-se que a configuração eletrônica é preenchida até o nível n = 3.
3. O cloro é o “halogênio especial”, pois é com o qual o sódio reage para formar o cloreto de sódio.
4. No sal de cloreto de sódio, a configuração eletrônica do cátion Na+ é preenchida até o nível n = 2, finalizando em 2s2 , 2p6 .
Assinale a alternativa correta.
Quatro balões esféricos são preenchidos isotermicamente com igual número de mols de um gás ideal. A temperatura do gás é a mesma nos balões, que apresentam as seguintes medidas de raio:
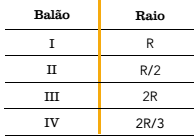
A pressão do gás é maior no balão de número:
Os modelos atômicos que conhecemos ajudam a explicar melhor a estrutura dos átomos, desde as ligações entre átomos até a previsão de comportamento de moléculas mais complexas como o DNA. Ao longo da história, vários modelos foram criados na tentativa de explicar melhor a natureza da matéria e sua constituição.
ALMEIDA, W. B. e Santos, H. F. Adaptado de Cadernos Temáticos de Química Nova na Escola, Modelos Teóricos para a compreensão da Estrutura da Matéria, n. 4, mai. 2001.
Dadas as seguintes afirmativas com respeito à evolução histórica do surgimento dos modelos atômicos,
I. A primeira concepção de modelo atômico considerava o átomo como uma partícula maciça e indivisível que comporia todas as substâncias, sendo idealizada por Dalton.
II. Com a descoberta dos elétrons e prótons, o modelo atômico de Dalton caiu por terra, visto que o átomo continha outras partículas e, portanto, não seria indivisível, conforme previa a teoria de Dalton.
III. Com a descoberta do núcleo, por Rutherford, observou-se que o modelo atômico proposto por J. J. Thomson possuía coerência e, portanto, concordava com os resultados experimentais.
IV. O atual modelo atômico leva em consideração os argumentos da teoria quântica, principalmente a quantização de energia que foi desenvolvida pelo físico alemão Max Planck no final de 1900.
V. O modelo atômico de Sammerfild propôs que as órbitas dos elétrons em torno do núcleo seriam órbitas circulares ao invés de órbitas elípticas, conforme previa a teoria proposta por Niels Bohr.
assinale a alternativa que contém a sequência com todas as afirmativas corretas.
Dois balões idênticos são confeccionados com o mesmo material e apresentam volumes iguais. As massas de seus respectivos conteúdos, gás hélio e gás metano, também são iguais. Quando os balões são soltos, eles alcançam, com temperaturas internas idênticas, a mesma altura na atmosfera.
Admitindo-se comportamento ideal para os dois gases, a razão entre a pressão no interior do balão contendo hélio e a do balão contendo metano é igual a:
A descoberta dos isótopos foi de grande importância para o conhecimento da estrutura atômica da matéria.
Sabe-se, hoje, que os isótopos 54Fe e 56Fe têm, respectivamente, 28 e 30 nêutrons.
A razão entre as cargas elétricas dos núcleos dos isótopos 54Fe e 56Fe é igual a:
Em uma das primeiras classificações periódicas, os elementos químicos eram organizados em grupos
de três, denominados tríades. Os elementos de cada tríade apresentam propriedades químicas
semelhantes, e a massa atômica do elemento central equivale aproximadamente à média aritmética
das massas atômicas dos outros dois. Observe as tríades a seguir:
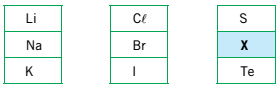
Com base nos critérios desta classificação, a letra X corresponde ao seguinte elemento químico:
A hemoglobina é uma proteína de elevada massa molar, responsável pelo transporte de oxigênio na corrente sanguínea. Esse transporte pode ser representado pela equação química abaixo, em que HB corresponde à hemoglobina.
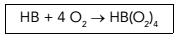
Em um experimento, constatou-se que 1 g de hemoglobina é capaz de transportar 2,24 x 10–4 L de oxigênio molecular com comportamento ideal, nas CNTP.
A massa molar, em g/mol, da hemoglobina utilizada no experimento é igual a:

