Questões de Vestibular
Sobre transformações químicas em química
Foram encontradas 1.192 questões
Áreas como a medicina, a agricultura e a indústria farmacêutica são beneficiadas com o desenvolvimento dos estudos da radioatividade. A radioterapia – técnica utilizada para destruir células cancerosas – faz uso, principalmente, de radioisótopos do iodo-131 para eliminar lesões identificadas nos radiodiagnósticos da tireoide.
Sobre esse radioisótopo, assinale a alternativa correta.
Assinale a alternativa correta.
Segundo pesquisas recentes, há uma bactéria que parece ser capaz de substituir o fósforo por arsênio em seu DNA.
Uma semelhança entre as estruturas atômicas desses elementos químicos que possibilita essa substituição é:
• Não usar próximo a chamas.
• Não descartar em incinerador.


A prata é um metal que apresenta excelente ductilidade e a maior condutividade elétrica dentre todos os elementos químicos.
Um fio de prata possui 10 m de comprimento (l) e área de secção transversal (A) de 2,0 × 10–7 m2.

Incêndio é uma ocorrência de fogo não controlado, potencialmente perigosa para os seres vivos. Para cada classe de fogo existe pelo menos um tipo de extintor. Quando o fogo é gerado por líquidos inflamáveis como álcool, querosene, combustíveis e óleos, os extintores mais indicados são aqueles com carga de pó químico ou gás carbônico.
Considerando-se a massa molar do carbono = 12 g.mol–1 , a massa molar do oxigênio = 16 g.mol–1 e R = 0,082 atm.L.mol–1 .K–1 , o volume máximo, em litros, de gás liberado a 27 ºC e 1 atm, por um extintor de gás carbônico de 8,8 kg de capacidade, é igual a:
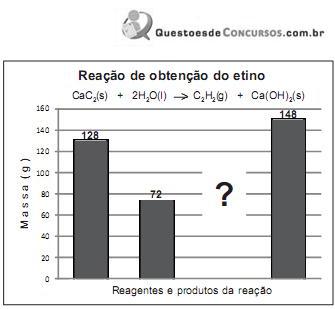
A massa, em gramas, de etino obtido nessa reação, que corresponde à coluna representada pelo ponto de interrogação, é
“No verão de 1774, Joseph Priestley, na Inglaterra, descobriu que quando se aquecia cal de mercúrio (óxido de mercúrio) ao rubro, dela desprendia um “ar” que, surpreendentemente, parecia ainda mais forte ou mais puro do que o ar comum. [...] Fascinado, Priestley investigou mais a fundo, descobrindo que camundongos podiam viver naquele ar ar por um tempo quatro vezes maior do que o ar comum. E assim, convencido de que aquele “novo” ar era benigno, ele próprio o experimentou.”
SACHS, Oliver. Tio Tungstênio. São Paulo: Companhia das Letras, 2002. P. 114.
O “novo ar” de que trata o texto é constituído essencialmente do elemento químico que
Com base nessas informações, é correto afirmar que
“Grande parte do interesse pelo sal, como os experimentos dos antigos chineses com o salitre, visava proporcionar aos militares métodos mais eficientes de detonar coisas e gente. No século XIX, descobriu- se que o clorato de potássio produzia uma explosão maior que a pólvora tradicional, o nitrato de potássio. E o magnésio tinha propriedades explosivas ainda mais impressionantes.”
KURLANSKY, Mark. Sal: uma história do mundo.
São Paulo: SENAC, 2004. p. 291.
O sal que produzia maior explosão provém da reação entre as substâncias de fórmulas
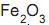 e impurezas. Ao se misturar 4,0 g de uma amostra deste minério com ácido clorídrico concentrado, obtêm- se 6,5 g de cloreto de ferro III. A porcentagem em massa de
e impurezas. Ao se misturar 4,0 g de uma amostra deste minério com ácido clorídrico concentrado, obtêm- se 6,5 g de cloreto de ferro III. A porcentagem em massa de 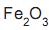 no minério é igual a
no minério é igual a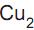 e CuO) se forma na superfície dos tachos, podendo se desprender e ser incorporado ao doce.
e CuO) se forma na superfície dos tachos, podendo se desprender e ser incorporado ao doce. Sobre o cobre e seus óxidos, é CORRETO afirmar que:
27