Questões de Vestibular PUC - SP 2016 para Vestibular- Primeiro Semestre
Foram encontradas 10 questões
Para o exercício, adote os seguintes valores quando necessário:

Dado: 1 pm equivale a 10-12 m
O raio iônico é a grandeza que mede o tamanho dos íons. Conhecer o raio dos íons auxilia na análise da energia reticular dos cristais iônicos, na compreensão da seletividade dos canais iônicos das membranas celulares e na interação dos íons em sítios específicos de enzimas.
Considerando os íons Ca2+, Cl– , K+, e Mg2+, a alternativa que melhor associa esses íons aos valores de raios iônicos é
Dado: Volume de 1 mol de gás na CNTPé 22,4 L
A água oxigenada é o nome dado à solução comercial de peróxido de hidrogênio (H2 O2 ) em água. Em lojas de produtos químicos é possível adquirir frascos contendo água oxigenada 200 volumes. Essa concentração indica que a decomposição total do peróxido de hidrogênio contida em 1,0 L de solução produz 200 L de gás oxigênio medidos na CNTP.
A reação de decomposição da água oxigenada é representada pela equação química a seguir

Desse modo, 50 mL dessa solução contém,
aproximadamente,
Dado:

A reação de hidrogenação do etileno ocorre com aquecimento, na presença de níquel em pó como catalisador. A equação termoquímica que representa o processo é
C2 H4 (g) + H2 (g) → C2 H6 (g) ΔHθ = - 137 kJ.mol-1
Dados:

São conhecidos alguns radioisótopos dos elementos polônio e rádio.
Em um experimento, duas amostras de massas diferentes, uma de polônio-208 e outra de rádio-224, foram mantidas em uma caixa de chumbo por 18 anos. Ao final desse período, verificou-se que a massa de cada um desses radioisótopos presente no recipiente era igual a 0,025 mg.
Sobre esse experimento foram feitas algumas observações:
I. A desintegração β do 224Ra resulta no isótopo 224Pa.
II. A desintegração α do 208Po resulta no isótopo 204Pb.
III. A massa inicial de 224Ra na caixa de chumbo era de 0,200 mg. 208
IV. A massa inicial de 208Po na caixa de chumbo era de 0,150 mg.
Estão corretas apenas as afirmações:
A tabela a seguir sintetiza os dados experimentais obtidos de um estudo cinético da reação.

A expressão da equação da velocidade nas condições dos experimentos é
A análise de um composto orgânico oxigenado de fórmula geral Cx Hy Oz permitiu uma série de informações sobre o comportamento químico da substância.
I. A combustão completa de uma amostra contendo 0,01 mol desse composto forneceu 1,76 g de CO2 e 0,72 g de água.
II. Esse composto não sofre oxidação em solução de KMnO4 em meio ácido.
III. A redução desse composto fornece um álcool.
Com base nessas afirmações é possível deduzir que o
nome do composto é
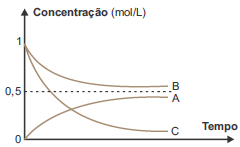
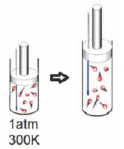
A respeito do experimento, foram feitas algumas afirmações:
I. A e B são reagentes e C é o produto da reação estudada. II. A reação química estudada é corretamente representada pela equação: B + 2 C → A III. Não houve consumo completo dos reagentes, sendo atingido o equilíbrio químico. IV. A constante de equilíbrio dessa reação, no sentido da formação de A, nas condições do experimento é menor do que 1.
Estão corretas apenas as afirmações:
Dados:
Constante de ionização (Ka) do H₂CO₃ = 4 x 10⁻⁷
Constante de ionização (Kb) do NH₃= 2 x 10⁻⁵
Constante de ionização (Kw) do H₂O = 1 x 10⁻¹⁴
Os indicadores ácido base são substâncias cuja cor se altera em uma faixa específica de pH. Atabela a seguir apresenta afaixa de viragem (mudança de cor) de alguns indicadores ácido base.
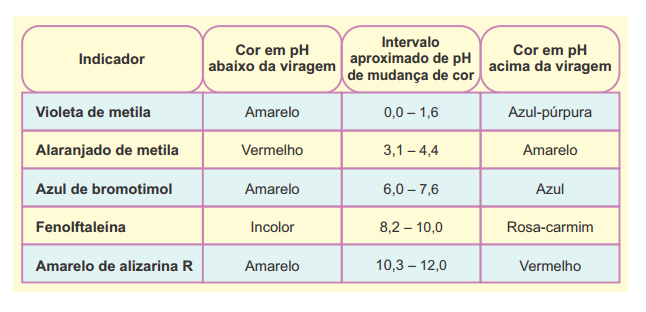
A partir da análise dessa tabela, um técnico executou um procedimento para distinguir algumas soluções.
Para diferenciar uma solução de 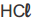 de concentração 1,0 mol.L⁻¹ de uma solução de
de concentração 1,0 mol.L⁻¹ de uma solução de 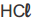 e concentração 0,01 mol.L⁻¹ ele utilizou o indicador X. Para diferenciar uma solução de bicarbonato de sódio (NaHCO₃) de concentração 0,01 mol.L⁻¹ ele utilizou o indicador Y. Para diferenciar uma solução de amoníaco (NH₃) de concentração 1,0 x 10⁻³ mol.L⁻¹ de uma solução de hidróxido de sódio (NaOH) de concentração 0,1 mol.L⁻¹ ele utilizou o indicador Z.
e concentração 0,01 mol.L⁻¹ ele utilizou o indicador X. Para diferenciar uma solução de bicarbonato de sódio (NaHCO₃) de concentração 0,01 mol.L⁻¹ ele utilizou o indicador Y. Para diferenciar uma solução de amoníaco (NH₃) de concentração 1,0 x 10⁻³ mol.L⁻¹ de uma solução de hidróxido de sódio (NaOH) de concentração 0,1 mol.L⁻¹ ele utilizou o indicador Z.
A alternativa que apresenta os indicadores X, Y e Z adequados para cada um dos procedimentos propostos pelo técnico é
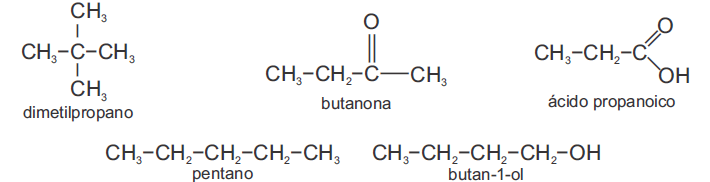
A alternativa que melhor associa as temperaturas de ebulição (Teb) com as substâncias é
