Questões do Enem Sobre química
Foram encontradas 488 questões
Para a produção de etanol combustível, as usinas retiram água do leito de rios próximos, reutilizando-a nas suas instalações. A vinhaça, resíduo líquido gerado nesse processo, é diluída para ser adicionada ao solo, utilizando uma técnica chamada de fertirrigação. Por meio desse procedimento, o fósforo e o potássio, essenciais à produção de cana-de-açúcar, são devolvidos ao solo, reduzindo o uso de fertilizantes sintéticos.
Essa intervenção humana no destino da vinhaça tem como resultado a diminuição do impacto ambiental referente à
Se dermos uma mordida em um pedaço de papel alumínio colocado em cima de uma obturação de amálgama (combinação do mercúrio metálico com metais e/ou ligas metálicas), sentiremos uma dor causada por uma corrente que pode chegar até 30 μA.
SILVA, R. R. et al. Química Nova na Escola, São Paulo, n. 13, maio 2001 (adaptado).
O contato dos materiais metálicos citados produz
A palha de aço, um material de baixo custo e vida útil pequena, utilizada para lavar louças, é um emaranhado de fios leves e finos que servem para a remoção por atrito dos resíduos aderidos aos objetos.
A propriedade do aço que justifica o aspecto físico descrito no texto é a
Após o desmonte da bateria automotiva, é obtida uma pasta residual de 6 kg, em que 19%, em massa, é dióxido de chumbo(IV), 60%, sulfato de chumbo(N) e 21%, chumbo metálico. O processo pirometalúrgico é o mais comum na obtenção do chumbo metálico, porém, devido à alta concentração de sulfato de chumbo(II), ocorre grande produção de dióxido de enxofre (SO2), causador de problemas ambientais. Para eliminar a produção de dióxido de enxofre, utiliza-se o processo hidrometalúrgico, constituído de três etapas, no qual o sulfato de chumbo(II) reage com carbonato de sódio a 1,0 mol/L a 45 °C, obtendo-se um sal insolúvel (etapa 1), que, tratado com ácido nítrico, produz um sal de chumbo solúvel (etapa 2) e, por eletrólise, obtém-se o chumbo metálico com alto grau de pureza (etapa 3).
ARAÚJO, R. V. V et al. Reciclagem de chumbo de bateria automotiva: estudo de caso. Disponível em: www.iqsc.usp.br. Acesso em: 17 abr. 2010 (adaptado).
Considerando a obtenção de chumbo metálico a partir de sulfato de chumbo(II) na pasta residual, pelo processo hidrometalúrgico, as etapas 1, 2 e 3 objetivam, respectivamente,
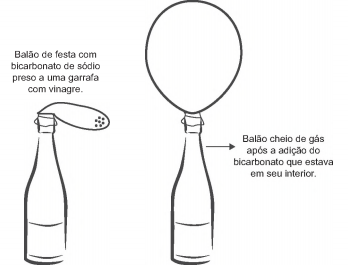
A transformação química em questão é representada pela equação:
O método de separação comumente usado para retirar o sulfato de alumínio com as impurezas aderidas é a
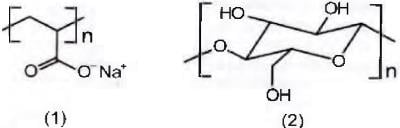
CURI. D Química Nova na Escola, São Paulo, n. 23, maio 2006 (adaptado).
A maior eficiência dessas fraldas descartáveis, em relação às de pano, deve-se às
LEE. J. D Química Inorgânica não tão concisa. São Paulo: Edgard Blucher. 1999 (adaptado).
Considerando que um forno foi alimentado com 2,5 toneladas de ferro-gusa, a massa de gás carbônico formada, em quilogramas, na produção de aço doce, é mais próxima de
SACKS. O. Tio Tungstênío; memórias de uma infância química. São Paulo: Cia, das Letras, 2002.
O fragmento do romance de Oliver Sacks relata a separação dos elementos que compõem a água. O princípio do método apresentado é utilizado industrialmente na
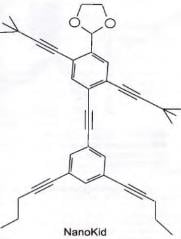
CHANTEAU, S. H.; TOUR, J. M. The Journal of Organic Chemistry. v. 68, n. 23. 2003 (adaptado).
Em que parte do corpo do NanoKid existe carbono quaternário?
Cl2 (g) + 2 H2O ( l ) ⥨ HCIO (aq) + H3O+ (aq) + Cl (aq)
HCIO (aq) + H2O (I) ⥨ H3O+ (aq) + CIO- (aq) pKa = - log Ka = 7,53
A ação desinfetante é controlada pelo ácido hipocloroso, que possui um potencial de desinfecção cerca de 80 vezes superior ao ânion hipoclorito. O pH do meio é importante, porque influencia na extensão com que o ácido hipocloroso se ioniza.
Para que a desinfecção seja mais efetiva, o pH da água a ser tratada deve estar mais próximo de
Para que se consiga atrair um maior número de abelhas para uma determinada região, a molécula que deve estar presente em alta concentração no produto a ser utilizado é:
Em um medicamento, a varfarina é administrada por via intravenosa na forma de solução aquosa, com concentração de 3,0 mg/mL. Um indivíduo adulto, com volume sanguíneo total de 5,0 L, será submetido a um tratamento com solução injetável desse medicamento.
Qual é o máximo volume da solução do medicamento que pode ser administrado a esse indivíduo, pela via intravenosa, de maneira que não ocorram hemorragias causadas pelo anticoagulante?
4 FeS2 (s) + 15O2 (g) + 2 H2O (I) ➙ 2 Fe2(SO4)3 (aq) + 2 H2 SO4 (aq)
FIGUEIREDO, B. R. Minérios e ambiente. Campinas: Unicamp, 2000.
Para corrigir os problemas ambientais causados por essa drenagem, a substância mais recomendada a ser adicionada ao meio é o
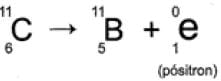
A partir da injeção de glicose marcada com esse nuclídeo, o tempo de aquisição de uma imagem de tomografia é de cinco meias-vidas.
Considerando que o medicamento contém 1,00 g do carbono-1 1 , a massa, em miligramas, do nuclídeo restante, após a aquisição da imagem, é mais próxima de
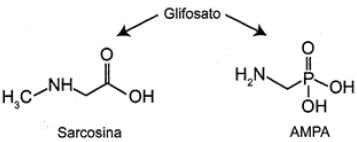
AMARANTE JR „ O. P. et al. Quimíca Nova. São Pauto, v. 25, n, 3, 2002 (adaptado).
A partir do texto e dos produtos de degradação apresentados, a estrutura química que representa o glifosato é:
ROSA, A, H.: COELHO, J. C. R. Cadernos Temáticos de Química Nova na Escola. São Paulo, n. 5, nov. 2003 (adaptado).
De que maneira as práticas agrícolas podem ajudar a minimizar o agravamento do efeito estufa?
Disponível em: www.anvisa.gov.br. Acesso em: 1 ago. 2012 (adaptado).
Considerando-se o valor de 6 X 1023 mol-1 para a constante de Avogadro e a massa molar do cálcio igual a 40 g/mol, qual a quantidade mínima diária de átomos de cálcio a ser ingerida para que uma pessoa supra suas necessidades?
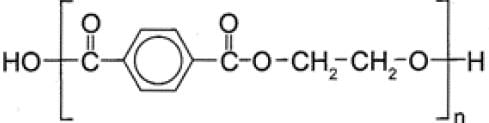
Disponível em: wwwabrpet.org.br. Acesso em: 27 fev. 2012 (adaptado).
Com base nas informações do texto, uma alternativa para a obtenção de etilenoglicol a partir do PET é a
CORRÊA. A. G.; ZUIN, V. G. (Orgs). Química Verde: fundamentos e aplicações. São Carlos: EdUFSCar. 2009.
À luz da Química Verde, métodos devem ser desenvolvidos para eliminar ou reduzir a poluição do ar causada especialmente pelas