Questões Militares
Para cabo do corpo de bombeiro
Foram encontradas 367 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
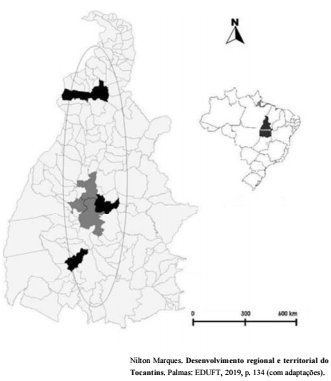
Na figura anterior, que corresponde ao mapa do estado do
Tocantins, os municípios destacados
Divergências levaram, desde a primeira metade do século XVIII, a uma oposição entre o norte e o sul do estado de Goiás. As duas regiões se relacionavam apenas em atos administrativos isolados, com objetivos meramente fiscais ou jurídicos. A amplitude geográfica dificultava o relacionamento interno norte-sul. A região norte era de difícil acesso, com povoamentos rarefeitos e esparsos, distantes da sede administrativa no sul.
Nilton Marques. Desenvolvimento regional e territorial do Tocantins.
Palmas: EDUFT, 2019, p. 73 (com adaptações).
No início do movimento separatista entre o norte e o sul de Goiás, houve
A seguir, destaca-se em cinza-escuro a mesorregião do norte goiano.
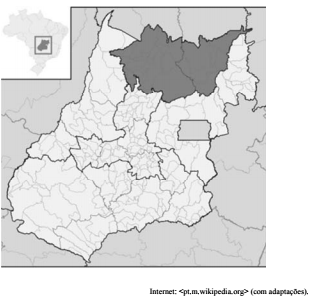
A economia do norte goiano inicialmente desenvolveu-se a partir
Três frascos foram encontrados sem rótulo na bancada de um laboratório. Um deles continha solução de KOH a 0,1 mol/L; o outro, solução de CaCl2 a 0,05 mol/L; e o outro, solução de CH3CH2COOH a 0,1 mol/L. Na tentativa de identificar a solução contida em cada um deles, um técnico usou volumes iguais das soluções dos frascos para medir a pressão de vapor sob mesma temperatura, utilizando um sistema adequado. Os resultados obtidos estão indicados pelos ponteiros dos manômetros nesta figura.
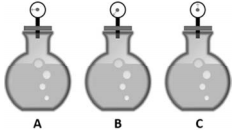
Com base nas informações e na figura apresentadas, é correto
afirmar que os frascos identificados por A, B e C contêm,
respectivamente, as soluções de
Em meados do século XX, as pilhas alcalinas surgiram como uma alternativa muito mais eficiente energeticamente em comparação às pilhas tradicionais. Como mostra a seguinte figura, a pilha alcalina utiliza os mesmos eletrodos da tradicional, porém o seu eletrólito é uma solução aquosa de hidróxido de sódio concentrada (~30% em massa) contendo uma dada quantidade de óxido de zinco ― daí a denominação alcalina para essa pilha.
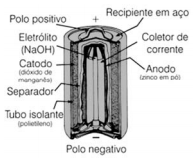
Internet:<http://qnesc.sbq.org.br> (com adaptações).
Uma mistura de carbonato de sódio decahidratado e bicarbonato de sódio foi colocada em um cadinho e levada a uma mufla a 350 °C por 3 h, tendo ocorrido as seguintes reações.
Na2CO3 · 10 H2O(s) → Na2CO3(s) + 10 H2O(v)
2 NaHCO3(s) → Na2CO3(s) + H2O(v) + CO2(g)
Finalizado o processo, restou unicamente carbonato de
sódio no cadinho, verificando-se uma perda total de massa de
6,70 g.
Sabendo que M(H) = 1 g/mol, M(C) = 12 g/mol,
M(O) = 16 g/mol e M(Na) = 23 g/mol, e supondo que a
quantidade de CO2 seco desprendido do cadinho seja igual a
2,20 g, assinale a opção que indica a quantidade, em gramas, de
Na2CO3 · 10 H2O existente na mistura inicial.
O gás propano, um dos componentes do gás de cozinha, pode ser preparado pela reação entre carvão — C(s) — e hidrogênio gasoso — H2(g).
C3H8(g) + 5 O2(g) → 3 CO2(g) + 4 H2O(l) ΔH° = −2.220 kJ
C(s) + O2(g) → CO2(g) ΔH° = −394 kJ
H2(g) + ½ O2(g) → H2O(l) ΔH° = −286 kJ
Com base nos calores de formação fornecidos, e sabendo-se que
M(H) = 1 g/mol, M(C) = 12 g/mol e M(O) = 16 g/mol, é correto
concluir que o módulo da variação de entalpia (ΔH1g) obtida na
preparação de 1 g de propano pelo processo citado, nas
condições padrão, é tal que
As aminas de cadeia curta, como as mostradas a seguir, possuem cheiro rançoso e desagradável, semelhante ao odor de peixe.
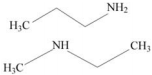
A intensidade do cheiro depende fundamentalmente da estrutura
da molécula, ainda que a fórmula molecular seja a mesma. Isso
decorre do fenômeno da isomeria, que, no caso das aminas em
apreço, é do tipo
Visando estudar o equilíbrio a seguir, um experimentador adicionou quantidades equimolares de tricloreto de fósforo e cloro gasoso em um reator a 180 °C.
PCl3(g) + Cl2(g) ⇌ PCl5(g)
Atingido o equilíbrio, foi verificada uma concentração de 1 x 10−4 mol/L de pentacloreto de fósforo.
Admitindo que, a 180 °C, a constante do equilíbrio em apreço
seja igual a 0,64, assinale a opção que indica a concentração de
cloro gasoso presente no equilíbrio.
Industrialmente, o PCl5 é sintetizado em reator fechado por meio da cloração do PCl3, de acordo com a equação química a seguir.
PCl3(g) + Cl2(g) ⇌ PCl5(g) ΔH = −124 kJ/mol
Conforme o princípio de Le Châtelier, o rendimento desse
processo pode ser aumentado