Questões de Concurso
Sobre validação de métodos analíticos e garantia da qualidade em farmácia
Foram encontradas 461 questões
A responsabilidade pela liberação do produto final é do detentor do registro, independentemente de alguma etapa da sua produção ou de o controle de qualidade ter sido efetuado por terceiros.
A empresa transportadora que realize o armazenamento
de medicamentos ou produtos biológicos deve ser
detentora de autorização de funcionamento (AFE),
sendo dispensável a licença sanitária.
Em relação à RDC n.º 234/2018, que institui regras para a terceirização de etapas de produção, de análises de controle de qualidade, de transporte e de armazenamento de medicamentos e produtos biológicos, julgue o item.
A empresa contratada não é solidariamente
responsável, perante as autoridades sanitárias, pelos
aspectos técnicos, operacionais e legais inerentes à
atividade objeto da terceirização.
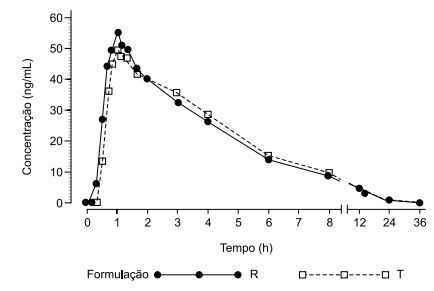
O ensaio para determinação de bioequivalência foi realizado em condições padronizadas, e, após a análise dos dados, foram obtidos os valores de concentração máxima (Cmáx), ASC0–t (área sobre a curva 0-48h) e ASC0–¥ (área sobre a curva 0-infinito) para as amostras de referência e teste, calculadas a razão entre as médias geométricas e o intervalo de confiança 90%, conforme a tabela a seguir.
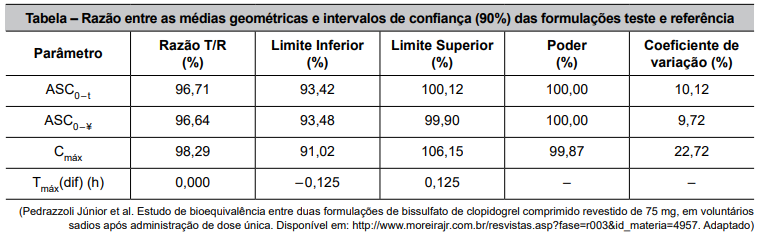
Com base nessas informações, é correto afirmar que
Um teste de uniformidade de doses unitárias foi realizado segundo o método geral 5.1.6 da Farmacopeia Brasileira, 5ª edição (Anvisa, 2010), e foram obtidos os seguintes valores:
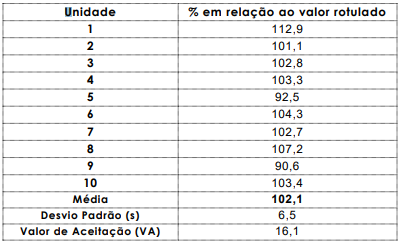
Com base nesses dados, conclui-se que
Para que um método de análise seja utilizado na rotina de um laboratório de controle de qualidade, é necessário que ele seja validado. No Brasil, os requisitos para a validação de um método analítico são descritos na RDC 166/2017 da Anvisa. Considere as seguintes afirmativas sobre os parâmetros de validação.
I Limite de detecção é a menor quantidade do analito presente em uma amostra que pode ser detectado, porém, não necessariamente quantificado, sob as condições experimentais estabelecidas.
II Precisão é o grau de concordância entre os resultados individuais do método em estudo em relação a um valor aceito como verdadeiro.
III Robustez é a capacidade de identificar ou quantificar o analito de interesse, inequivocamente, na presença de componentes que podem estar na amostra, como , impurezas, diluentes e componentes da matriz.
IV Linearidade é a capacidade de uma metodologia analítica de demonstrar que os resultados obtidos são diretamente proporcionais à concentração do analito na amostra, dentro de um intervalo especificado.
Estão corretas as afirmativas
Acerca de sistema de gestão da qualidade, de validação de metodologias analíticas e dos requisitos técnicos da norma ABNT NBR ISO/IEC 17025:2017, julgue o item subsecutivo.
Em caso de reclamação ao laboratório, as conclusões a
serem informadas ao reclamante devem ser analisadas criticamente por indivíduo que não esteja envolvido nas
atividades de laboratório que tenham motivado a queixa.
Acerca de sistema de gestão da qualidade, de validação de metodologias analíticas e dos requisitos técnicos da norma ABNT NBR ISO/IEC 17025:2017, julgue o item subsecutivo.
Atividades de laboratório podem ser providas externamente
se o laboratório não tiver recurso financeiro ou equipe
técnica capacitada para realizá-las.
Acerca de sistema de gestão da qualidade, de validação de metodologias analíticas e dos requisitos técnicos da norma ABNT NBR ISO/IEC 17025:2017, julgue o item subsecutivo.
Temperatura e som são variáveis que podem comprometer
a validade de resultados de exames realizados em laboratório.
Acerca de sistema de gestão da qualidade, de validação de metodologias analíticas e dos requisitos técnicos da norma ABNT NBR ISO/IEC 17025:2017, julgue o item subsecutivo.
Para a identificação de produto químico ou biológico
empregando-se o método cromatográfico, deve-se comprovar
a pureza cromatográfica do sinal do analito.