Questões de Concurso
Sobre validação de métodos analíticos e garantia da qualidade em farmácia
Foram encontradas 461 questões
I. o preparo do inóculo e a fermentação ocorrem em área com pressão negativa classe grau B e as etapas cromatográficas ocorrem em áreas com pressões positivas também classe grau B. II. os sistemas de filtração esterilizante são operados em módulo de fluxo laminar localizado em sala com pressão positiva e classe grau B. III. todas as etapas de obtenção do IFA estéril podem ser realizadas em área classe grau C.
Assinale:
I. mínimo de seis leitos dispostos em local que garanta a privacidade e a não exposição do voluntário a pacientes ou a riscos de contrair doenças.
II. supervisão médica durante todo o período do confinamento.
III. existência de infra-estrutura para atendimento de emergências decorrentes do procedimento.
IV. a estocagem das amostras deve ser feita em congeladores em que haja controle de temperatura em tempo integral.
Assinale:
I. caso o método seja destinado à quantificação de mais de um fármaco, todos devem ser injetados para determinar os tempos de retenção.
II. deve-se analisar amostras de branco da matriz biológica obtidas de oito indivíduos, sendo seis amostras normais, uma lipêmica e uma hemolisada.
III. os resultados das amostras de branco devem ser comparados com aqueles obtidos com solução aquosa do analito, em concentração próxima ao limite superior de quantificação.
IV. os interferentes podem ser componentes da matriz biológica, metabólitos, produtos de decomposição e medicamentos utilizados concomitantemente ao estudo.
Assinale:
I. referências oficializadas pela Farmacopéia Brasileira.
II. padrões secundários, desde que a identidade e o teor sejam devidamente comprovados.
III. substâncias sintetizadas em laboratório de pesquisa com alto índice de recuperação.
IV. o sal do princípio ativo utilizado na produção do medicamento.
Assinale:
Assinale:
I. todos os processos de fabricação devam ser claramente definidos e sistematicamente revisados em função da experiência adquirida.
II. devem ser capazes de fabricar medicamentos dentro dos padrões de qualidade exigidos, atendendo às respectivas especificações.
III. sejam realizadas as qualificações e validações necessárias.
IV. que seja implantado um sistema capaz de recolher qualquer lote, após sua comercialização ou distribuição, na ocasião da identificação de algum desvio de qualidade. O prazo de recolhimento deverá ser de 45 a 60 dias.
Assinale:
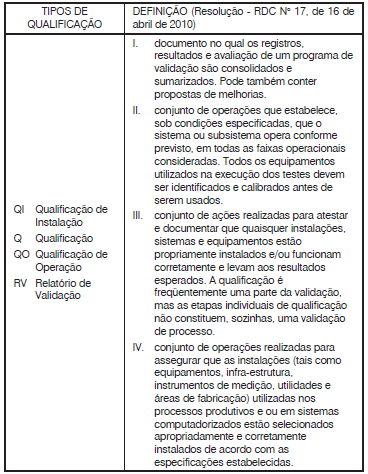
Está correto apenas o que se afirma em
I. Procedimentos Operacionais Padrão (POP).
II. especificações.
III. Plano Mestre de Validação (PMV).
IV. protocolos e relatórios de qualificação.
V. protocolos e relatórios de validação.
Assinale: