Questões de Concurso
Sobre validação de métodos analíticos e garantia da qualidade em farmácia
Foram encontradas 461 questões
I. O equipamento deve estar visualmente limpo.
II. Qualquer agente ativo do produto após a limpeza deve estar presente em níveis máximos de 10 ppm ou 10 mg/g do produto após a limpeza em relação ao produto subseqüente.
III. Qualquer agente ativo do produto após a limpeza deve estar presente em níveis máximos de 1/100 da dose mínima diária da substância ativa em relação à dose máxima diária do produto subseqüente, calculado de acordo com a equação seguinte (LeBlanc, 1999):
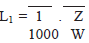
Onde:
L1 = Limite no produto subseqüente em mg/g
Z = Dose mínima diária do produto a ser limpo
Assinale:
“dependendo da função e operação do equipamento, utilidade ou sistema, em determinadas situações, somente se fazem necessárias a __________ e a __________, assim como a operação correta do equipamento, utilidades ou sistemas pode ser considerada um indicador suficiente de seu __________."
De acordo com a legislação em referência, assinale a alternativa que melhor preenche os espaços da sentença.
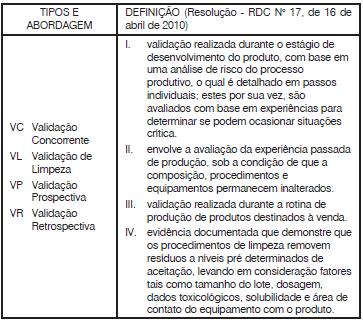
Estão corretas as associações
I. instalações, utilidades, sistemas computadorizados, equipamentos e processos foram projetados em consonância com as exigências de BPF (qualificação de projeto ou QP).
II. instalações, utilidades, sistemas computadorizados e equipamentos foram construídos e instalados de acordo com as suas especificações de projeto (qualificação de instalação ou QI).
III. instalações, utilidades, sistemas computadorizados e equipamentos operam de acordo com suas especificações planejadas (qualificação de operação ou QO).
IV. uma metodologia analítica e um processo específico produzirá um produto que consistentemente atenda suas especificações e atributos de qualidade (validação de processo ou VP, também chamada em alguns casos de qualificação de desempenho ou QD).
Assinale:
I. fórmula mestra e especificações.
II. procedimentos operacionais.
III. registros (ex., registros de calibração, manutenção e limpeza).
IV. métodos analíticos.
Assinale
I. infra-estrutura apropriada ou "sistema de qualidade", englobando instalações, procedimentos, processos e recursos organizacionais.
II. ações sistemáticas necessárias para assegurar com confiança adequada que um produto (ou serviço) cumpre seus requisitos de qualidade. A totalidade dessas ações é chamada de "garantia da qualidade".
III. fundamentos e diretrizes da norma NBR ISO 9001:2000 que estabelece os requisitos mínimos para implantação do Sistema de Gestão da Qualidade.
Assinale:
Em relação aos aspectos gerais dos biofármacos (proteínas terapêuticas), analise as afirmativas a seguir.
I. Entre os fatores que afetam a imunogenicidade das proteínas terapêuticas pode-se citar: glicosilação, pureza, sequência de aminoácidos, excipientes e estabilidade.
II. A imunogenicidade de uma proteína terapêutica é independente da formulação e da via de administração.
III. A complexidade das proteínas terapêuticas pode ser definida por comparabilidade ou similaridade frente a um produto de referência.
Assinale:
Em relação aos aspectos gerais dos biofármacos (proteínas terapêuticas), analise as afirmativas a seguir:
I. As proteínas terapêuticas inovadoras devem demonstrar segurança e eficácia através de estudos pré-clínicos e clínicos. Os estudos clínicos se classificam em fase I, II e III prévios ao registro.
II. As proteínas terapêuticas geralmente são produzidas por organismos vivos, que inerentemente são variáveis. Qualquer mudança no processo de manufatura, por menor que seja, pode levar a mudanças no produto que podem ou não ser detectáveis pelas tecnologias atuais de controle.
III. As proteínas terapêuticas em geral são muito estáveis e, via de regra, são prescritas por administração oral. Se aplicadas de forma parental, podem ser degradas pela corrente sanguínea.
Assinale:
I. Técnicas analíticas que façam uso de métodos de cromatografia gasosa (CG) ou cromatografia líquida de alta eficiência (CLAE).
II. Métodos não-cromatográficos, desde que estes ofereçam uma seletividade aceitável (por ex. titulometria, espectrofotometria UV-VIS).
III. Testes histoquímicos realizados com materiais fixados em glutaraldeído em tampão fosfato e emblocados em historresina.
Assinale:
I. controle da Encefalopatia Espongiforme Transmissível (EET) de acordo com a legislação vigente.
II. resultados do estudo de estabilidade acelerada de três lotes-piloto, acompanhados dos estudos de estabilidade de longa duração em andamento, ou estudos de estabilidade de longa duração já concluídos, todos de acordo com o "Guia para a realização de estudos de estabilidade de medicamentos" publicado pela ANVISA na RE 01, de 29 de julho de 2005, ou suas atualizações.
III. referências farmacopeicas consultadas e reconhecidas pela ANVISA, de acordo com a legislação vigente. Quando não forem utilizadas referências farmacopeicas reconhecidas pela ANVISA, deve ser apresentada descrição detalhada de todas as metodologias utilizadas no controle de qualidade, com métodos analíticos validados de acordo com o "Guia de validação de métodos analíticos e bioanalíticos" publicado pela ANVISA na RE 899, de 29 de maio de 2003, ou suas atualizações, indicando a fonte de desenvolvimento.
Assinale: