Questões de Química - Grandezas: massa, volume, mol, massa molar, constante de Avogadro e Estequiometria. para Concurso
Foram encontradas 961 questões
A pílula anticoncepcional é fabricada com diferentes tipos de hormônios. Os mais usuais são o estrogênio e a progesterona. Nas pílulas de baixa dosagem hormonal é encontrado o etinilestradiol (C20H24O2), derivado sintético do estrogênio, em diferentes proporções. Um laboratório recebeu uma amostra contendo 2035 g de etinilestradiol contaminado e verificou que o grau de pureza do hormônio era de 80%. Como a purificação da amostra era inviável, foi constatada a necessidade de descartar todo o material recebido. O número de moles do hormônio que foram encaminhados para incineração é de:
Dados: H = 1 g/mol; C = 12 g/mol; O = 16 g/mol
Uma amostra que pesa 1,55 g contém fósforo na forma de dihidrogenofosfato de sódio (NaH2PO4). Após receber tratamento adequado, a amostra foi misturada com solução de íons magnésio (Mg2+) e com solução de íons amônio, obtendo-se um precipitado de fosfato duplo de magnésio e amônio, conforme a reação a seguir:
H2PO4- + Mg2+ + NH4+ + 6H2O → MgNH4PO4 ˑ 6H2O(s) + 2H+
No procedimento de análise, o precipitado, após lavado e seco, foi decomposto a pirofosfato de magnésio (Mg2P2O7) conforme a reação abaixo.
2MgNH4PO4 ˑ 6H2O(s) 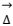 Mg2P2O7(s) + 2NH3(g) + 13H2O(g)
Mg2P2O7(s) + 2NH3(g) + 13H2O(g)
Se a massa de pirofosfato de magnésio obtida foi de 1,11 g, o teor de fósforo na amostra é
A calcinação do sulfato de bário, em condições de reagir, fornece duas espécies, sendo uma delas um óxido gasoso de enxofre e a outra um óxido básico. A massa, em gramas, do referido gás, obtida a partir de 0,5 mol de sulfato de bário, é de:
Dado: Ba= 137,5.