Questões de Concurso Sobre química
Foram encontradas 13.542 questões
Em 1923, o químico dinamarquês Johannes Brønsted (1879- 1947) e o químico inglês Thomas Lowry (1874-1936) propuseram uma definição de ácidos e bases mais geral do que a proposta anteriormente por Arrhenius (1859-1927).
O conceito de Brønsted- Lowry está baseado no fato de que a reação ácido-base envolve transferência de íons H+ de uma substância para outra.
Analise o equilíbrio a seguir:
HSO3 – (aq)+ H2O(ℓ) ⇄ H2SO3(aq) +OH– (aq)
Baseado nesse conceito, os pares conjugados são:
A amônia atmosférica é de fundamental importância para a química ambiental, pois se trata de um composto capaz de neutralizar, em determinada extensão, gases ácidos e espécies ácidas adsorvidas em partículas.
Em uma determinada temperatura, a amônia apresenta pKb= 5. Nessas condições uma solução 0,1mol.L–1 de amônia apresentará valor de pH igual a
Dado: pKw = 14
Uma mistura gasosa de 10 mmol de CO e 10 mmol de H2O é colocada em um reator de 500 mL e aquecida até 500 °C, atingindo o equilíbrio:
CO(g) + H2O(g) ⇄ CO2(g) + H2(g) com Kc = 4,00
A concentração, em mol.L–1 de dióxido de carbono nesse
equilíbrio é de
A reação de cloro gasoso com uma base forte pode ser descrita pela equação
Cℓ2(g) + 2 NaOH(aq) → NaCℓ(aq) + NaOCℓ(aq) + H2O(ℓ)
Para o posterior preparo de 0,5 litro de solução 0,2 mol.L–1 de hipoclorito de sódio obtido por meio desse processo, a massa de hidróxido de sódio que deve reagir em presença de excesso de cloro gasoso é, no mínimo, igual a
Dados: Massas molares H = 1g.mol–1 ; O = 16g.mol–1 Na = 23g.mol–1
Para uma determinada pratica em laboratório é necessário o preparo de 200 mL de solução 0,5 mol.L–1 de ácido nítrico a partir de uma solução concentrada desse ácido. A solução concentrada é identificada por: 65%(m/m) e densidade 1,4g.cm–3 .
O volume a ser utilizado dessa solução é de, aproximadamente,
Dados: Massas molares: H = 1g.mol-1 ; N = 14g.mol-1 ; O = 16g.mol-1
Em relação à Cromatografia gasosa, NÃO é correto afirmar:
• Resolução: separação real dos picos. • Seletividade: posição relativa dos picos. • Eficiência: capacidade de eluição com o mínimo de dispersão.
Considere o cromatograma:
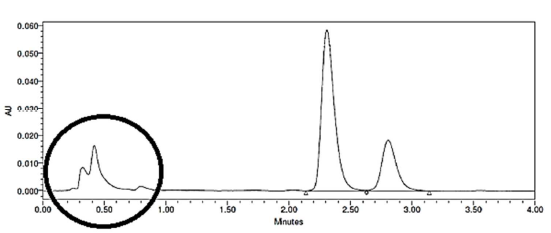
Fonte: https://www.researchgate.net/figure/Figura-5-Exemplo-de-um-cromatograma-doextrato-de-permetrina-obtido-do-tecido-com_fig5_281496769
Se classificarmos a resolução (boa ou má), seletividade (boa ou má) e eficiência (boa ou má), a parte assinalada com um círculo é, respectivamente:
I. É um método de separação no qual os componentes que interagem mais fortemente com a fase móvel são retidos antes daqueles que são favorecidos pela fase estacionária. II. Tem como princípio de funcionamento a diferença de afinidade de diferentes compostos de uma amostra complexa com a fase estacionária para separação desses compostos quando submetidos a um fluxo de fase móvel líquida. III. O tempo de retenção é o tempo gasto por um componente desde a sua injeção até a sua detecção na saída do sistema.
São VERDADEIRAS as afirmativas:
Considere dois procedimentos:
1. Liofilização: congelamento seguido de vácuo com ou sem temperatura. 2. Esmagamento entre duas superfícies.
Os procedimentos citados referem-se, respectivamente à
I. os eletrodos estejam conectados externamente, através de um condutor metálico. II. as duas soluções de eletrólitos estejam em contato, permitindo o movimento de íons entre elas. III. uma reação de transferência de elétrons possa ocorrer em cada um dos eletrodos.
São CORRETAS as afirmativas:
A concentração de NaCl é, em mol/L,
4 análises são realizadas ao mesmo tempo, nas mesmas condições e com a mesma concentração de Ag+ .
Dado:
Composto / Kps Agl / 8,3 x 10-17 AgBr / 5,2 x 10-13 AgCl / 1,8 x 10-10 AgIO3 / 3 x 10-8
Se as análises envolverem os íons I- , Br- , Cl- e IO3 - qual deles precipitará primeiro?
Um laboratorista construiu o seguinte gráfico durante uma titulação ácido-base.
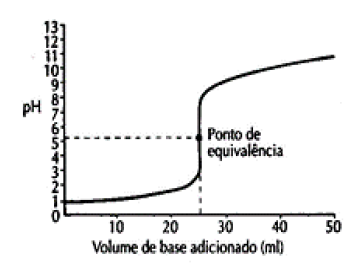
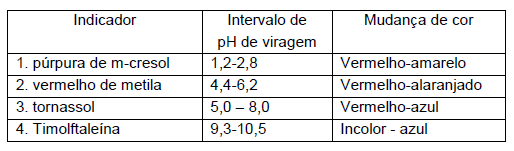
Dos 4 indicadores, qual seria o mais adequado para determinar o ponto de equivalência?
A precisão do método é criticamente dependente das propriedades desse composto.
Padrão secundário: substância que tem sua concentração determinada por análise química e é utilizada como referência em análises volumétricas.
O NaOH é um sólido muito higroscópico (absorve umidade do ar), além de reagir com o dióxido de carbono do ar, sendo transformado em carbonato de sódio e água, conforme a equação:
2 NaOH + CO2 Na2-->CO3 + H2O
Com base nessas informações, o hidróxido de sódio é um
É muito comum encontramos álcool no mercado com a indicação: 77oGL.
Gay Lussac (°GL = %V): quantidade em mililitros de álcool absoluto contida em 100 mililitros de mistura hidro-alcoólica.
É comum também, ao lado da concentração em v/v da solução hidro-alcoólica, encontrarmos a indicação INPM.
INPM (%P = porcentagem de álcool em peso ou grau alcoólico INPM): quantidade em gramas de álcool absoluto contida em 100 gramas de mistura hidro-alcoólica. Se quisermos converter 77oGL em INPM, encontraremos o valor:
Dado: densidade do álcool = 0,8 g.cm-3 e da água = 1,0 g.cm-3
Considere as figuras abaixo:

A figura
Para a reação:
H2(g) + CO2(g) ↔ H2O(g) + CO(g)a 700°C, a constante de equilíbrio para concentrações Kc = 0,534. Calcule o número
de mols de H2(g) presentes no equilíbrio, se uma mistura de 0,300 mol de
CO(g) e 0,300 mol de H2O(g) for aquecida a 700°C em um recipiente de 10,0 L.