Questões de Concurso
Sobre velocidade de reação, energia de ativação, concentração, pressão, temperatura e catalisador em química
Foram encontradas 404 questões
A reação química genérica
2A(g) ⇋ B(g) + C(g) tem como expressão
de lei velocidade a 75°C 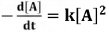 em que [A] é a concentração de A, em
mol/L, k é a constante de velocidade
dessa reação. Se [A]0 denota a
concentração inicial de A no instante
t = 0, então a concentração de A, em
qualquer instante t, pode ser calculada
por meio da expressão
em que [A] é a concentração de A, em
mol/L, k é a constante de velocidade
dessa reação. Se [A]0 denota a
concentração inicial de A no instante
t = 0, então a concentração de A, em
qualquer instante t, pode ser calculada
por meio da expressão
Uma reação em fase gasosa se propaga em duas etapas, como indicado pelo diagrama energético a seguir:
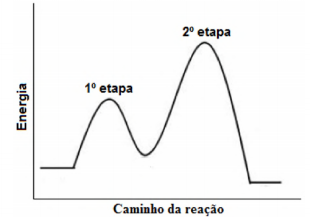
Em relação ao tema, assinale a alternativa
correta.
Considere a reação química genérica representada por x → Z , cujo gráfico da concentração de X em função do tempo é mostrada na seguinte figura.
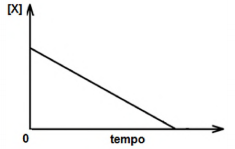
Em relação ao tema, analise as asserções a seguir:
A velocidade de consumo da substância X permanece constante durante todo o processo da reação.
PORQUE
A reação dada tem ordem global zero.
Referente às asserções, é correto
afirmar que
Três experimentos foram conduzidos, nas CNTP, objetivando investigar a cinética da reação genérica.
X + Y → Z
A tabela a seguir apresenta os resultados coletados desse experimento:

A velocidade de formação de Z, em
unidades do SI, quando as concentrações
de X e Y forem iguais a 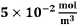 e
e 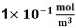 , respetivamente, é igual a
, respetivamente, é igual a
Três experimentos foram conduzidos, nas CNTP, objetivando investigar a cinética da reação genérica.
X + Y → Z
A tabela a seguir apresenta os resultados coletados desse experimento:

A constante de velocidade da reação,
em unidades do SI, é igual a
Três experimentos foram conduzidos, nas CNTP, objetivando investigar a cinética da reação genérica.
X + Y → Z
A tabela a seguir apresenta os resultados coletados desse experimento:

A ordem global da reação é igual a
O acetaldeído ou etanal é um aldeído que se decompõe segundo a equação abaixo:
CH3 CHO(g) → CH4(g) + CO (g)
A reação tem cinética de segunda ordem, e o valor da constante de velocidade, numa dada temperatura, é 9,0 × 10-5 L mol-1 s-1 .
O valor mais próximo da velocidade inicial de decomposição de 200 g de acetaldeído, dentro de um reator de 10 L, é
Dado
M(CH3
CHO) = 44 gmol-1
Os alquenos são matéria-prima de grande importância na indústria porque podem ser facilmente transformados em uma vasta gama de compostos químicos. Exemplos típicos são as reações de hidratação e de polimerização catalisadas por ácido. Com relação às reações de alquenos, julgue o item subsequente.
De acordo com a teoria das colisões, um aumento na
temperatura de reação ocasiona aumento no número total de
colisões entre as espécies reagentes e na fração de colisões
efetivas.
Os alquenos são matéria-prima de grande importância na indústria porque podem ser facilmente transformados em uma vasta gama de compostos químicos. Exemplos típicos são as reações de hidratação e de polimerização catalisadas por ácido. Com relação às reações de alquenos, julgue o item subsequente.
O efeito da adição do catalisador ácido é o de reduzir a energia
de ativação da reação e, com isso, aumentar a fração de
colisões efetivas.
Os alquenos são matéria-prima de grande importância na indústria porque podem ser facilmente transformados em uma vasta gama de compostos químicos. Exemplos típicos são as reações de hidratação e de polimerização catalisadas por ácido. Com relação às reações de alquenos, julgue o item subsequente.
A adição do catalisador ácido faz que o equilíbrio da reação
seja alcançado mais rapidamente; quando alcançado, o
equilíbrio estará mais deslocado para o sentido dos produtos.
Os alquenos são matéria-prima de grande importância na indústria porque podem ser facilmente transformados em uma vasta gama de compostos químicos. Exemplos típicos são as reações de hidratação e de polimerização catalisadas por ácido. Com relação às reações de alquenos, julgue o item subsequente.
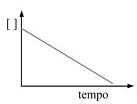
Se a reação de desidratação de um alqueno ocorre de acordo com uma cinética de pseudoprimeira ordem, então o gráfico da concentração do alqueno em função do tempo terá aspecto conforme indicado no gráfico a seguir.
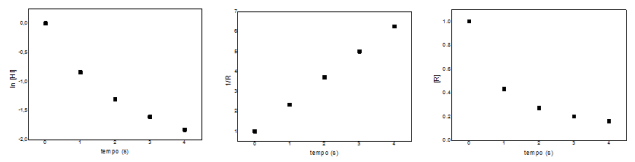
Baseado nos gráficos, assinale a alternativa correta.
Considerando as afirmações acima, assinale a alternativa correta.
I. Existem três variáveis que afetam as velocidades de reação: concentração, estado físico dos reagentes e temperatura. II. As equações de velocidade podem ser escritas para expressar como as concentrações variam com o tempo. III. Em nível molecular, as velocidades de reação dependem da frequência das colisões entre as moléculas, quanto maior a frequência das colisões, menor a velocidade de reação.
É correto afirmar que:
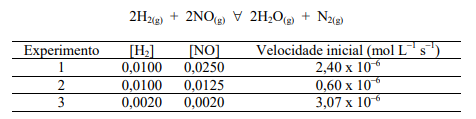
(CH3)3C-Br(l) + OH- (aq) → (CH3)3C-OH(l) + Br- (aq)
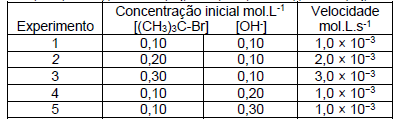
A partir dos dados fornecidos, assinale a alternativa que indica a equação da velocidade e a ordem da reação corretas.
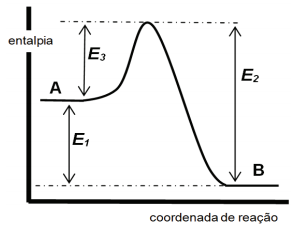 ( ) corresponde à entalpia da reação direta
( ) corresponde à energia de ativação da reação direta
( ) corresponde à entalpia da reação inversa
( ) corresponde à energia de ativação da reação inversa
( ) corresponde à entalpia da reação direta
( ) corresponde à energia de ativação da reação direta
( ) corresponde à entalpia da reação inversa
( ) corresponde à energia de ativação da reação inversa
Assinale a alternativa correta:
Assinale a alternativa correta: