Questões de Concurso
Sobre velocidade de reação, energia de ativação, concentração, pressão, temperatura e catalisador em química
Foram encontradas 404 questões
Dados: [A]0 = concentração inicial; k= constante de velocidade e t = tempo
O monóxido de nitrogênio, quando liberados pelos automóveis na baixa atmosfera, rapidamente se transforma em dióxido de nitrogênio, que em seguida, irá colaborar na formação do ozônio troposférico, um poluente. Um estudo dessa reação no laboratório revelou que, para que ela se tornasse quatro vezes mais rápida, poderia ser feita a seguinte alteração: manter fixa a concentração de O2 e duplicar a de NO.
Considerando o enunciado acima, atente para as seguintes afirmações:
I. A lei da velocidade dessa reação pode ser dada por: v = k[NO]2 [O2].
II. Essa deve ser uma reação elementar, ou seja,
realizada em apenas uma etapa.
Sobre essas afirmações, é correto diz que
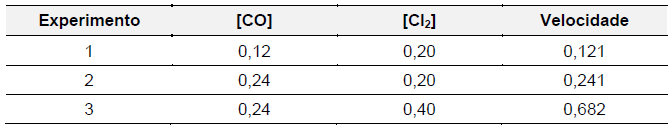
Dado que log 2,8 = 0,45 e log 2 = 0,3, o valor da constante da velocidade desta reação é
A seguir são apresentadas informações referentes à reação de decomposição do H2O2.


Considerando que a reação de decomposição do H2O2 seja exotérmica e se processe de acordo com uma cinética de primeira ordem, e que a constante universal dos gases seja igual a 8,3 J × mol-1 × K-1 , julgue o item subsequente, acerca da reação em questão.
A reação de decomposição do H2O2 libera maior quantidade de calor quando é realizada à pressão constante de 1 bar do que quando é realizada a volume constante.
A seguir são apresentadas informações referentes à reação de decomposição do H2O2.


Considerando que a reação de decomposição do H2O2 seja exotérmica e se processe de acordo com uma cinética de primeira ordem, e que a constante universal dos gases seja igual a 8,3 J × mol-1 × K-1 , julgue o item subsequente, acerca da reação em questão.
O fato de a reação de decomposição do H2O2 ser de primeira
ordem implica tratar-se de uma reação elementar.
A seguir são apresentadas informações referentes à reação de decomposição do H2O2.


Considerando que a reação de decomposição do H2O2 seja exotérmica e se processe de acordo com uma cinética de primeira ordem, e que a constante universal dos gases seja igual a 8,3 J × mol-1 × K-1 , julgue o item subsequente, acerca da reação em questão.
O tempo necessário para que a concentração de H2O2 caia a
10% do valor inicial equivale a 10 × ek
, em que k é a constante
de velocidade da reação de decomposição do H2O2.
A seguir são apresentadas informações referentes à reação de decomposição do H2O2.


Considerando que a reação de decomposição do H2O2 seja exotérmica e se processe de acordo com uma cinética de primeira ordem, e que a constante universal dos gases seja igual a 8,3 J × mol-1 × K-1 , julgue o item subsequente, acerca da reação em questão.
A curva resultante da plotagem do logaritmo neperiano da
concentração do H2O2 em função do tempo de reação resulta
em uma reta com inclinação negativa.
A seguir são apresentadas informações referentes à reação de decomposição do H2O2.


A partir do gráfico apresentado e de acordo com a equação de Arrhenius, é possível determinar que a energia de ativação da reação é superior a 1,0 × 105 J × mol-1 .


Com relação à reação apresentada e às espécies nela envolvidas, e considerando a primeira constante de ionização ácida do H2O2 igual a 2,4 × 10-12, julgue o item a seguir.
A quantidade de calor liberada por mol de moléculas de H2O2
decompostas é maior na reação realizada em presença do
catalisador do que na reação não catalisada.
A + 3B → 2C + D
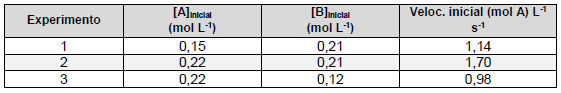
A partir dessas informações, considere as seguintes afirmativas:
1. A reação é de primeira ordem em relação ao reagente A, e também de primeira ordem em relação ao reagente B. 2. A lei de velocidade da reação, baseada na estequiometria da reação, é velocidade = k [A][B]3 , e a ordem global da reação é 4. 3. A lei de velocidade da reação, baseada nos dados experimentais, é velocidade = k [A][B], e a ordem global da reação é 2. 4. O valor de k para o experimento 2 é 36,79 L mol-1 s -1 .
Assinale a alternativa correta.
Fatores que influenciam a velocidade das reações químicas: A. superfície de contato.
B. catalisador. C. concentração. D. temperatura. E. inibidor.
( ) Um alimento é congelado para ser conservado por mais tempo. ( ) Uma barra de ferro oxida mais rapidamente se transformada em palha de aço. ( ) Gases resultantes do escapamento dos automóveis são convertidos em gases menos nocivos, contribuindo para a diminuição da poluição atmosférica. ( ) Para evitar que um alimento deteriore em pouco tempo, pode-se embalá-lo a vácuo. ( ) Os Parabenos são substâncias muito usadas na indústria com a finalidade de conservar cosméticos, permitindo que o prazo de validade dos mesmos seja maior.
Assinale a sequência que ilustra o preenchimento CORRETO dos parênteses, de cima para baixo:
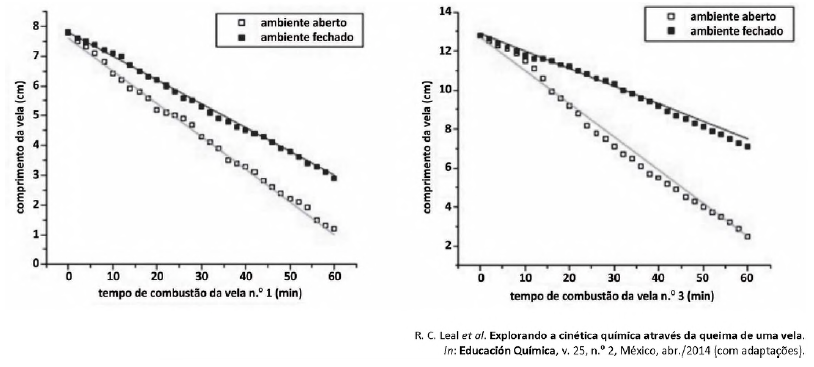
Acerca da variação na velocidade de queima das velas, assinale a alternativa correta.
A reação entre metanol e ácido bromídrico segue o seguinte mecanismo:
(1) CH3OH + H+ ↔ CH3OH2+ (rápida)
(2) CH3OH2 + → CH3OH + H+ (rápida)
(3) CH3OH2 + + Br- → CH3Br + H2O (lenta)
A partir deste mecanismo, indique a alternativa que apresenta a lei de velocidade de formação do brometo
de metila, d[CH3Br]/dt, por meio da citada reação.
Para determinar a equação de velocidade correspondente a um dado mecanismo, são feitos os seguintes passos:
01. Localizar a etapa lenta no mecanismo. A velocidade da reação global será a velocidade desta etapa.
02. Escrever a equação de velocidade para a etapa lenta. Para isso, é notado que o expoente de um reagente na equação de velocidade para uma etapa é seu coeficiente na equação para essa etapa.
03. Se a equação de velocidade obtida em 02 contiver um intermediário instável, o termo dessa espécie deve ser eliminado. Frequentemente, isto pode ser feito trabalhando-se com a constante de equilíbrio para uma etapa rápida no mecanismo.
De acordo com as informações anteriores, assinale a alternativa que corresponde aos passos para a determinação da equação de velocidade.
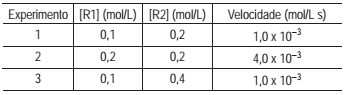
A equação química abaixo é da reação, que ocorre no estado gasoso, entre dois reagentes (R1 e R2 ) formando um produto único P.
R1(g) + R2(g) → P(g)
De um conjunto de experimentos foram coletados dados
que foram organizados na seguinte Tabela: